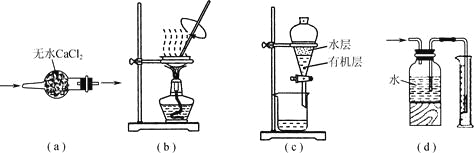
题目内容
【题目】煤、石油是人类目前使用的主要能源,同时也是重要的化工原料。
Ⅰ.石油经分馏、裂化、裂解可以获得C4H10、CH4、C3H6、C2H6、C2H4等许多重要的化工原料。
已知:i.C4H10(g)![]() CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
ii.C4H10(g)![]() C2H6(g)+C2H4(g)
C2H6(g)+C2H4(g)
CH3CH2CH2CH3与![]() 的平衡转化率随温度变化的关系如图1所示。
的平衡转化率随温度变化的关系如图1所示。

(1)![]() 的名称是___;其一氯代物有___种,结构简式分别是___。
的名称是___;其一氯代物有___种,结构简式分别是___。
(2)660℃时,取1molCH3CH2CH2CH3通入2L恒容密闭容器中发生反应i、ii,经过30min达到平衡,C2H6的体积分数为![]() 。
。
①达平衡时反应物转化率为___,30min内,用C2H6表示的平均反应速率v(C2H6)为___。
②达到平衡时,CH4的物质的量分数为___%(精确到0.1)。
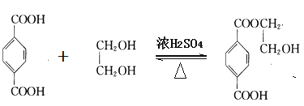
Ⅱ.用煤干馏得到的二甲苯和乙烯为原料合成涤纶(聚酯纤维)的路线如下:

(3)①写出A![]() B的化学方程式:__,反应类型是___。
B的化学方程式:__,反应类型是___。
②若1mol![]() 与1mol
与1mol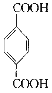 酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
酯化反应的生成物中含两个环,写出该物质的结构简式:___;若生成物中只含一个环,写出反应的化学方程式___。
【答案】2-甲基丙烷 2 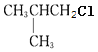 、
、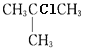 70% 0.005mol/(L·min) 23.5 CH2=CH2+Br2
70% 0.005mol/(L·min) 23.5 CH2=CH2+Br2![]() CH2BrCH2Br 加成反应
CH2BrCH2Br 加成反应 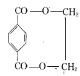
 +H2O
+H2O
【解析】
(1)![]() 主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种;
主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种;
(2)①由图可知,660℃时CH3CH2CH2CH3的平衡转化率为70%;由反应方程式可知,每反应1分子CH3CH2CH2CH3时,生成两分子的气体,即体积增大两倍,平衡时反应的CH3CH2CH2CH3的物质的量为1mol×70%=0.7mol,剩余CH3CH2CH2CH30.3mol,则此时总物质的量为0.7mol×2+0.3mol=1.7mol,生成C2H6的物质的量为1.7mol×![]() =0.3mol,可以求出反应速率;
=0.3mol,可以求出反应速率;
②由①可知,达到平衡时,C2H6的物质的量为0.3mol,则生成C2H4的物质的量也是0.3mol,可知CH4的物质的量=(0.7mol×2-0.3×2)×0.5=0.4mol;
(3)①A![]() B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2
B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2![]() CH2BrCH2Br;反应类型是加成反应;
CH2BrCH2Br;反应类型是加成反应;
②1mol![]() 与1mol
与1mol 酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是
酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是 ;若生成物中只含一个环则
;若生成物中只含一个环则![]() 中的一个羟基和
中的一个羟基和 一个羧基发生酯化反应,方程式为
一个羧基发生酯化反应,方程式为 +H2O。
+H2O。
(1)![]() 主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种,结构简式分别是
主链有3个C,支链在2号位上,名称是2-甲基丙烷;结构中三个甲基的环境相同,一共有两种不同环境的氢,它的一氯代物只有2种,结构简式分别是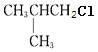 、
、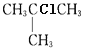 ;
;
(2)①由图可知,660℃时CH3CH2CH2CH3的平衡转化率为70%;由反应方程式可知,每反应1分子CH3CH2CH2CH3时,生成两分子的气体,即体积增大两倍,平衡时反应的CH3CH2CH2CH3的物质的量为1mol×70%=0.7mol,剩余CH3CH2CH2CH30.3mol,则此时总物质的量为0.7mol×2+0.3mol=1.7mol,生成C2H6的物质的量为1.7mol×![]() =0.3mol,则C2H6表示的平均反应速率v(C2H6)=
=0.3mol,则C2H6表示的平均反应速率v(C2H6)=  =0.005mol/(L·min);
=0.005mol/(L·min);
②由①可知,达到平衡时,C2H6的物质的量为0.3mol,则生成C2H4的物质的量也是0.3mol,可知CH4的物质的量=(0.7mol×2-0.3×2)×0.5=0.4mol,CH4的物质的量分数为![]() ×100%=23.5%;
×100%=23.5%;
(3)①A![]() B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2
B是乙烯和溴单质的加成反应,方程式为:CH2=CH2+Br2![]() CH2BrCH2Br;反应类型是加成反应;
CH2BrCH2Br;反应类型是加成反应;
②1mol![]() 与1mol
与1mol 酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是
酯化反应中两个羟基分别和两个羧基结合,生成两个环的有机物是 ;若生成物中只含一个环则
;若生成物中只含一个环则![]() 中的一个羟基和
中的一个羟基和 一个羧基发生酯化反应,方程式为
一个羧基发生酯化反应,方程式为 +H2O。
+H2O。

【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是![]()
选项 | 实验 | 现象 | 结论 |
A | 向2mL | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B | 往 | 产生白色胶状沉淀 | 酸性: |
C | 常温下将铝片加入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |
D | 将 | 紫色溶液褪色 |
|
A.AB.BC.CD.D
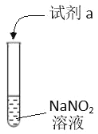
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O