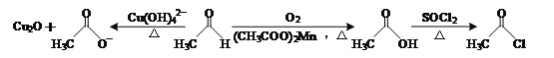题目内容
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
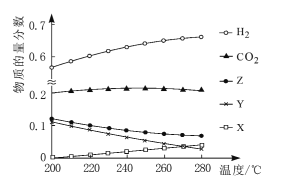
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
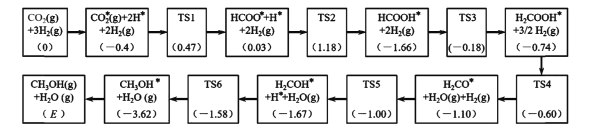
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
【答案】-90.6 温度改变时,反应i和反应ii平衡移动方向相反 < D CO、CH3OH HCOOH*+2H2(g)=H2COOH*+3/2H2 -0.51 阳 CO2+6e-+6H+=CH3OH+H2O
【解析】
(1)已知:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
根据盖斯定律可知反应i-ii可得反应iii,所以△H3=△H1-△H2=-49.4kJ/mol-41.2kJ/mol=-90.6kJ/mol;
(2) △H1<0,△H3<0,即生成甲醇的反应均为放热反应,所以温度升高平衡时甲醇的物质的量分数应减小,△H2>0,生成CO的反应为吸热反应,所以随温度升高CO平衡时的物质的量分数会变大,二者共同作用导致水蒸气减小幅度小于甲醇,所以Z代表H2O,Y代表CH3OH,X代表CO。
①依据主要反应的化学方程式可知,反应i消耗CO2,反应ii逆向产生CO2,最终体系内CO2的物质的量分数与上述两个反应进行的程度相关。由于△H1<0而△H2>0,根据勒夏特列原理,温度改变时,反应i和反应ii平衡移动方向相反,且平衡移动程度相近,导致体系内CO2的物质的量分数受温度的影响不大;
②反应ii平衡常数K=![]() ,该反应前后气体体积计量数之和不变,所以可以用物质的量分数来代表浓度估算K值,据图可知250℃时,CO2与H2的物质的量分数大于CO和H2O的物质的量分数,所以K<1;
,该反应前后气体体积计量数之和不变,所以可以用物质的量分数来代表浓度估算K值,据图可知250℃时,CO2与H2的物质的量分数大于CO和H2O的物质的量分数,所以K<1;
③A. 加入适量CO,促使反应iii平衡正向移动,产生更多的CH3OH,而反应ii平衡逆向移动,又可减少CO2转化为CO,使更多的CO2通过反应i转化为CH3OH,故CH3OH产率提高,A项正确;
B. 增大压强,有利于反应i和iii的平衡正向移动,而对反应ii无影响,B项正确;
C. 循环利用原料气能提高CO2的转化率,使CH3OH的产率提高,C项正确;
D. 由图可知,升温,CH3OH的物质的量分数下降,产率降低,D项错误;
综上所述选D;
④根据分析可知X代表CO,Y代表CH3OH;
(3)①生成CH3OH的决速步骤,指反应历程中反应速率最慢的反应。速率快慢则由反应的活化能决定,活化能越大,反应速率越慢。仔细观察并估算表中数据,找到活化能(过渡态与起始态能量差)最大的反应步骤为:HCOOH*+2H2(g)=H2COOH*+3/2H2,Ea=-0.18-(-1.66)= 1.48 eV;
②反应i的△H1= -49.4kJ/mol,指的是1mol CH3OH(g)和1molH2O(g)的总能量与1 mol CO2(g)和3mol H2(g)的总能量之差,而反应历程图中的E表示的是1个CH3OH分子和1个H2O分子的相对总能量与1个CO2分子和3个H2分子的相对总能量之差(单位为cV),且将起点的相对总能量设定为0。所以,作如下换算即可求得相对总能量E:
E=![]() =
=![]() =-0.51eV;
=-0.51eV;
(4)因为电解过程CO2被还原为CH3OH,H2应发生氧化反应,故氢气通入阳极附近溶液中;而阴极上CO2转化为CH3OH,碳元素从+4价降为-2价,电解质溶液为硫酸,所以电极方程式为:CO2+6e-+6H+=CH3OH+H2O。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】碱式氧化(NiOOH)可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
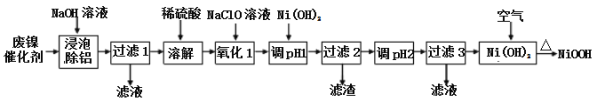
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_____________________。
(2)“过滤1”用到的玻璃仪器________________________________________。
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为_______________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式________________。
(5)在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO
,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO![]() 沉淀完全(c(CrO
沉淀完全(c(CrO![]() )≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
)≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。