题目内容
4.盐是一类常见的电解质,事实表明盐的溶液不一定呈中性.(1)CH3COONa、NH4Cl、KNO3 的水溶液分别呈碱性、酸性、中性.
(2)CH3COONa和NH4Cl 在水溶液中水解的离子方程式分别为:CH3COO-+H2O?CH3COOH+OH-、NH4++H2O?NH3•H2O+H+.
(3)盐类的水解在日常生活中也有一定的应用,如实验室配制FeCl3 溶液时,通常是把FeCl3固体溶解在稀盐酸中.在日常生活中,常用纯碱溶液洗涤油污物品.
(4)向碳酸氢钠溶液中滴加少量澄清石灰水,反应的离子方程式为2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-;向碳酸氢钠溶液中滴加过量澄清石灰水,反应的离子方程式为HCO3-+Ca2++OH-=H2O+CaCO3↓.
分析 (1)CH3COONa是强碱弱酸盐水解显碱性,NH4Cl是强酸弱碱盐水解显酸性,KNO3 是强酸强碱盐不水解显中性;
(2)CH3COONa是强碱弱酸盐水解显碱性,水解方程式为:CH3COO-+H2O?CH3COOH+OH-,NH4Cl是强酸弱碱盐水解显酸性,水解方程式为:NH4++H2O?NH3•H2O+H+;
(3)FeCl3 易水解,所以配制时要用HCl抑制其水解;纯碱溶液因水解显碱性,有去污能力;
(4)石灰水少量,则离子方程式按照碳酸氢钠的组成书写,碳酸根离子有剩余;碳酸氢钠和过量石灰水反应,碳酸氢钠全部反应生成碳酸钙沉淀.
解答 解:(1)CH3COONa是强碱弱酸盐水解显碱性,NH4Cl是强酸弱碱盐水解显酸性,KNO3是强酸强碱盐不水解显中性;
故答案为:碱;酸;中;
(2)CH3COONa是强碱弱酸盐水解显碱性,水解方程式为:CH3COO-+H2O?CH3COOH+OH-,NH4Cl是强酸弱碱盐水解显酸性,水解方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:CH3COO-+H2O?CH3COOH+OH-;NH4++H2O?NH3•H2O+H+;
(3)FeCl3 易水解,所以配制时通常是把FeCl3固体溶解在稀盐酸中;纯碱溶液因水解显碱性,有去污能力,常用纯碱溶液洗涤油污物品,
故答案为:稀盐酸;纯碱;
(4)向碳酸氢钠溶液中滴入少量澄清石灰水,反应生成碳酸钙、碳酸钠和水,反应的离子方程式为:2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓;
碳酸氢钠溶液中加入过量的澄清石灰水,碳酸氢钠全部反应,反应的离子方程式为:HCO3-+Ca2++OH-═CaCO3↓+H2O,
故答案为:2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-;HCO3-+Ca2++OH-=H2O+CaCO3↓.
点评 本题考查了盐的水解原理、离子方程式酸性,题目难度中等,明确盐的水解原理、离子方程式的书写原则为解答关键,注意掌握盐的水解原理及其影响因素;(4)为易错点,注意反应物过量情况对生成物影响.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案(1)甲同学认为是:Br2溶于水变成黄色溶液;乙认为是:Fe2+被氧化成Fe3+使溶液变成黄色.
(2)现提供试剂:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液
并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | 四氯化碳 | |
| 第二种方法 | 硫氰化钾溶液 |
(4)向稀溴化亚铁溶液中通入过量氯气的离子反应方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
| A. | Al3+ Mg2+ Cl- SO42- | B. | K+ Na+ Cl- HCO3- | ||
| C. | Fe2+ K+ NO3- SO42- | D. | K+ Ba2+ NO3- Cl- |
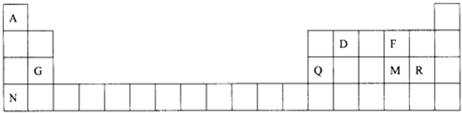
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
①Al2O3 ②Al(OH)3 ③Al ④NaHCO3 ⑤NaHS ⑥CaCO3 ⑦NaHSO4 ⑧(NH4)2CO3.
| A. | 除⑥外 | B. | 除⑥、⑦外 | C. | 除⑥、⑦、⑧外 | D. | 除①、②、③、④、⑤外 |
| A. | 有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH)4-、Fe3+、HCO3- | |
| B. | 某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | |
| C. | 固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 | |
| D. | 加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
| A. | 澄清透明的溶液中:K+、SO42-、Cu2+、Cl- | |
| B. | 0.1mol/L 的FeCl2的溶液中:H+、Na+、NO3-、Cl- | |
| C. | 使甲基橙变红的溶液中:K+、HCO3-、Ba2+、I- | |
| D. | c(H+)/c(OH-)=1×10-12:NH4+、Cl-、Ca2+、Br- |
 .
.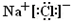 ,Na在F单质中燃烧的产物是Na2O2.
,Na在F单质中燃烧的产物是Na2O2.