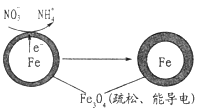
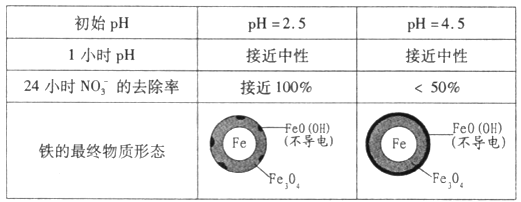
题目内容
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
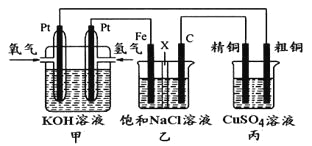
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),负极的电极反应式为 。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为 。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为 ;丙装置中阴极析出铜的质量为 。
【答案】(1)正极 H2-2e-+2OH-=2H2O
(2)阴极 2Cl -2e-=Cl2↑(3)铁极
(4)减小(5)1.204×1023或0.2NA 12.8 g
【解析】试题分析:(1)燃料电池中通入氧气的电极是正极,负极上氢气失电子,电极反应式为:H2-2e-+2OH-=2H2O;
(2)乙池属于电解池,铁电极是阴极,石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑;
(3)乙池中阴极是铁,阳极是碳,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子逐渐增大,所以乙装置中生成氢氧化钠主要在铁极区;
(4)如果粗铜中含有锌、银等杂质,则阳极上的铜、锌、银都会失电子进入溶液,阴极上析出铜离子,根据得失电子守恒,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小;
(5)根据方程式中的转化关系:O2----2H2----2Cu,2.24 L氧气的物质的量为0.1mol,则生成氢气的分子数是0.2×6.02×1023=1.204×1023,生成铜的质量是0.2×64=12.8g。

【题目】下表给出14~17号元素的一些性质,请回答:
14Si | 15P | 16S | 17Cl | |
单质与H2 | 高温 | 磷蒸气与 | 加热 | 光照或点燃 |
最高价氧化 | H4SiO4 | H3PO4[ | H2SO4 | HClO4 |
(1)它们所形成的氢化物中稳定性最差的是 ,还原性最差的是 。(写化学式)
(2)四种元素的非金属性随着元素原子序数的递增而逐渐 (增强或减弱)
(3)写出下列物质电子式K2S PCl3
【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
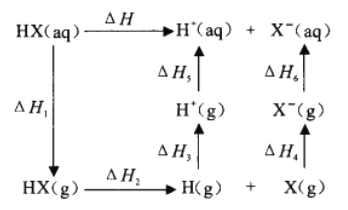
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。