题目内容
下列变化过程中,化学键没有被破坏的是
| A.HCl溶于水 | B.干冰升华 |
| C.固体NaCl熔融 | D.煤矿中瓦斯(主要成分CH4)遇火爆炸 |
B
解析试题分析:A.HCl溶于水破坏共价键,变为自由移动的离子,错误;B.干冰升华破坏的是分子间作用力,没有破坏化学键,正确;C. 固体NaCl熔融破坏的是离子键,错误;D.煤矿中瓦斯(主要成分CH4)遇火爆炸发生了化学反应,所有的化学键都发生了变化,错误。
考点:考查化学键与物质变化的关系的知识。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。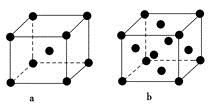
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 |
| B.分子中只有共价键的化合物一定是共价化合物 |
| C.离子键就是阴、阳离子间相互吸引 |
| D.只有非金属原子间才能形成共价键 |
下列过程中,共价键被破坏的是 ( )
| A.碘升华 | B.HCl气体溶于水 | C.酒精溶于水 | D.溴蒸气被木炭吸附 |
下列各组分子中,都属于含极性键的非极性分子的是
| A.C2H4 C6H6 | B.CO2 H2O2 |
| C.C60 C2H4 | D.NH3 HBr |
下列电子式书写正确的是
A. | B. | C. | D. |
下列说法正确的是( )
| A.CHCl3是正四面体形 |
| B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形 |
| C.二氧化碳中碳原子为sp杂化,为直线形分子 |
D.NH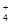 是三角锥形 是三角锥形 |
下列有关作用力的说法正确的是
| A.金属键、离子键、分子间作用力都没有方向性和饱和性 |
| B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱 |
| C.离子键、金属键、氢键、范德华力本质上都是静电作用 |
| D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键 |