题目内容
下列说法正确的是( )
| A.CHCl3是正四面体形 |
| B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形 |
| C.二氧化碳中碳原子为sp杂化,为直线形分子 |
D.NH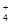 是三角锥形 是三角锥形 |
C
解析试题分析:A、CHCl3是四面体形,但不是正四面体形,A不正确;B、H2O分子中氧原子为sp3杂化,B不正确;C、二氧化碳中碳原子为sp杂化,为直线形分子,C正确;D、NH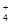 是正四面体形,D不正确,答案选C。
是正四面体形,D不正确,答案选C。
考点:考查分子的空间结构与原子的杂化轨道类型判断

练习册系列答案
 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )。
| A.Na | B.Fe | C.C | D.Ne |
下列变化过程中,化学键没有被破坏的是
| A.HCl溶于水 | B.干冰升华 |
| C.固体NaCl熔融 | D.煤矿中瓦斯(主要成分CH4)遇火爆炸 |
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1mol N-N吸收167kJ热量,生成1 mol N≡N放出942kJ热量,根据以上信息判断,下列说法正确的是
| A.1mol N4转变成N2将放出882kJ热量 | B.N4属于一种新型的化合物 |
| C.N4与N2互为同分异构体 | D.N4是由极性键组成的分子 |
用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
| A.CS2是V形分子 | B.SnBr2键角大于120° |
| C.BF3是三角锥形分子 | D.NH4+键角等于109.5° |
下列各组微粒属于等电子体的是( )
| A.CO和CO2 | B.NO和NO2 | C.CH4和NH3 | D.CO2和N2O |
有机物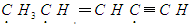 中标有“·”的碳原子的杂化方式依次为
中标有“·”的碳原子的杂化方式依次为
| A.sp、sp2、sp3 | B.sp3、sp2、sp | C.sp2、sp、sp3 | D.sp3、sp、sp2 |
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
| A.范德华力、范德华力、范德华力 |
| B.用范德华力、范德华力、共价键 |
| C.范德华力、共价键、共价键 |
| D.共价键、共价键、共价键 |
下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤冰融化 ⑥NH4Cl“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
| A.①④⑥⑦ | B.④⑥⑧ | C.①②④⑤ | D.④⑥ |