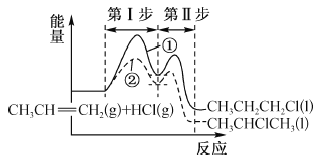
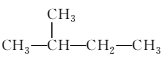题目内容
【题目】现有七种短周期元素①H、②C、③N、④O、⑤Na、⑥ Al、⑦Cl。
(1)①与③形成的简单氢化物的电子式是__________________,工业上利用该化合物制备NO的化学方程式_________________________________。
(2)⑤的单质在④的单质中燃烧,生成淡黄色固体。该产物中含有的化学键的类型是______________。
(3)②和⑦的气态氢化物中热稳定性较强的是__________(用化学式表示);能表示出②和⑦最高价氧化物水化物的酸性强弱的离子方程式是______________________________。
(4)①-⑦几种元素中,最高正价氧化物为两性的是__________(用化学式表示);写出它与氢氧化钠反应的化学方程式 __________________________________________。
【答案】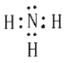 4NH3+5O2
4NH3+5O2![]() 4NO+6H2O 非极性共价键和离子键 HCl CO32-+2H+=H2O+CO2↑ Al2O3 Al2O3+2NaOH=2NaAlO2+H2O
4NO+6H2O 非极性共价键和离子键 HCl CO32-+2H+=H2O+CO2↑ Al2O3 Al2O3+2NaOH=2NaAlO2+H2O
【解析】
(1)氢元素与氮元素形成的简单氢化物为NH3,电子式是![]() ,工业上利用氨气和氧气在催化剂加热作用下反应制备NO,化学方程式4NH3+5O2
,工业上利用氨气和氧气在催化剂加热作用下反应制备NO,化学方程式4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)钠在氧气中燃烧,生成淡黄色固体过氧化钠,过氧化钠属于离子化合物,由钠离子和过氧根离子构成,含有离子键和非极性共价键;
(3)元素非金属性越强,其对应简单气态氢化物的稳定性越强,非金属性:Cl>C,则气态氢化物中热稳定性较强的是HCl;根据强酸制弱酸的规律,能体现C和Cl最高价氧化物水化物的酸性强弱的反应为,高氯酸和碳酸钠反应生成高氯酸钠、二氧化碳和水,离子方程式是CO32-+2H+=H2O+CO2↑;
(4)①-⑦几种元素中,最高正价氧化物为两性的是Al2O3;Al2O3与氢氧化钠反应生成偏铝酸钠和水,化学方程式Al2O3+2NaOH=2NaAlO2+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案