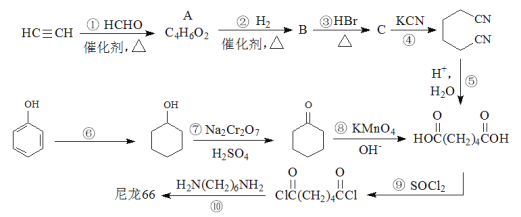
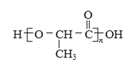
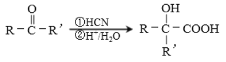
��Ŀ����
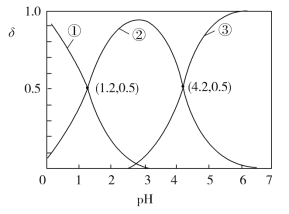
����Ŀ����֪H2C2O4ˮ��Һ��H2C2O4��HC2O4-��C2O42-������̬�����ӵ����ʵ����������ֲ�ϵ����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
A.������������������HC2O4-
B.H2C2O4��Ka1=-1.2
C.�������Һ�еμ�KOH��Һ��pH=4.2��c(K+)��3c(C2O42-)
D.Ũ�Ⱦ�Ϊ0.01 mol��L1�IJ�����KOH��Һ�������ϲ���ַ�Ӧ�õ�����Һ��c(K+)��c(HC2O4-)��c(H2C2O4)��c(C2O42-)
���𰸡�C
��������
H2C2O4ˮ��Һ�����Լ�ǿ����Ҫ����H2C2O4����������������Ϣ������������������Ӧ��H2C2O4������pH������H2C2O4����һ�����룬����HC2O4-��H+����֪���ߢڴ���������ΪHC2O4-�������ߢ۴���������ΪC2O42-����ͼ��֪����pH=1.2ʱ��c(HC2O4-)=c(H2C2O4)����pH=4.2ʱ��c(HC2O4-)=c(C2O42-)���ݴ˽��з�����
A�������Խ�ǿ��������Ҫ����H2C2O4������������������Ӧ��H2C2O4��A�����
B��H2C2O4�ĵ�һ�����뷽��ʽΪH2C2O4![]() HC2O4-+H+��Ka1=
HC2O4-+H+��Ka1=![]() ����ͼ��֪��pH=1.2ʱ��c(HC2O4-)=c(H2C2O4)����Ka1=c(H+)=101.2��B�����
����ͼ��֪��pH=1.2ʱ��c(HC2O4-)=c(H2C2O4)����Ka1=c(H+)=101.2��B�����
C��pH=4.2ʱ����Һ����Ҫ���ڵ������У�K+��H+��C2O42-��HC2O4-��OH�����ݵ���غ�ɵã�c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH)����Һ��c(HC2O4-)=c(C2O42-)��c(H+)��c(OH)���ɵó�c(K+)��3c(C2O42-)��C����ȷ��
D��Ũ�Ⱦ�Ϊ0.01 mol��L1�IJ�����KOH��Һ�������ϲ���ַ�Ӧ�õ�KHC2O4��Һ����Һ�����ԣ�˵��HC2O4-�ĵ������ˮ�⣬��c(K+)��c(HC2O4-)��c(C2O42-)��c(H2C2O4)��D�����
��ѡC��

����Ŀ��������������C9H10O2������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȣ����Ʊ�����Ϊ��
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
��֪��
��ɫ��״̬ | �е㣨�棩 | �ܶȣ�gcm��3�� | |
������* | ��ɫƬ״���� | 249 | 1.2659 |
���������� | ��ɫ����Һ�� | 212.6 | 1.05 |
�Ҵ� | ��ɫ����Һ�� | 78.3 | 0.7893 |
������ | ��ɫ����Һ�� | 80.8 | 0.7318 |
*��������100���Ѹ��������ʵ�鲽�����£�
����Բ����ƿ�м���12.20g�����ᡢ25mL�Ҵ�����������20mL�����飬�Լ�4mLŨ���ᣬ��Ͼ��Ȳ������ʯ������ͼ��ʾװ�������������¶���6570����Ȼ���2h����Ӧʱ������һ�Ҵ���ˮ���γɡ���������е�62.6�棩��������������÷�ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��������������Ҵ���
�ڷ�Ӧ�������������ų���ˮ����Һ��ر��������������ȣ�����ˮ�����ռ�����Һ�岻���������ӣ�ֹͣ���ȣ�
�۽���ƿ�ڷ�ӦҺ����ʢ������ˮ���ձ��У���������Na2CO3����Һ�����ԣ�
���÷�Һ©���ֳ��л��㣬ˮ����25mL������ȡ��Һ��Ȼ��ϲ����л��㣮�����Ȼ��ƣ��Դֲ����������װ����ͼ��ʾ���������������Ѻ������£�����210213�����֣�
�ݼ���ϸ�ò�Ʒ���Ϊ13.16mL��
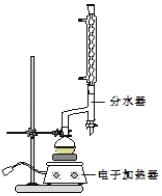
��1���ڸ�ʵ���У�Բ����ƿ���ݻ����ʺϵ���_____��������ȷѡ��ǰ����ĸ����
A.25mL B.50mL C.100mL D.250mL
��2��������з�ʯ��������____��ʹ�÷�ˮ�����Ϸ����ȥˮ��Ŀ����_____��
��3�������Ӧ������ֵ��¶���__��
A.215220�� B.8590�� C.7880�� D.6570��
��4������ۼ���Na2CO3��������________����Na2CO3���벻�㣬��֮������ʱ��������ƿ�пɼ����������ɣ������������ԭ����________��
��5�����ڲ�����е���ȡ��Һ����������ȷ����____��
A��ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������Һ©����ת������������ҡ
B����ҡ���κ����Һ©���¿ڵIJ���������
C����������ҡ���������ֳַ�Һ©�����ô�Һ��ֲ�
D���ų�Һ��ʱ��Ӧ���Ͽڲ������������ϵİ��۶�©�����ϵ�С��
��6�����㱾ʵ��IJ���Ϊ____��