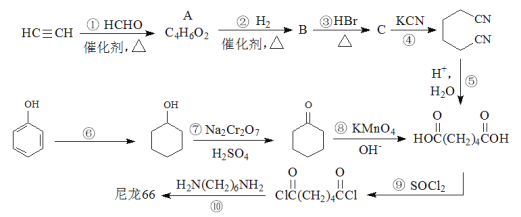
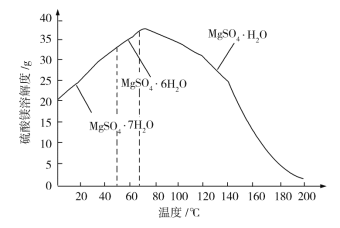
题目内容
【题目】常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气。某探究小组在实验室对氨气与氯气反应进行了探究,回答下列问题。
Ⅰ.氨气的制备
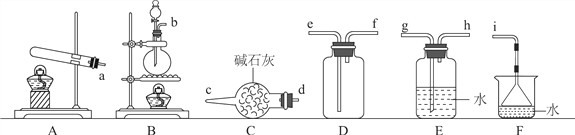
(1)氨气的发生装置可以选择上图中的________(填大写字母),反应的化学方程式为____________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→________(填小写字母)。
Ⅱ.氯气与氨气的反应
室温下,用收集到的氨气按下图所示装置进行实验(实验前k1、k2关闭)。
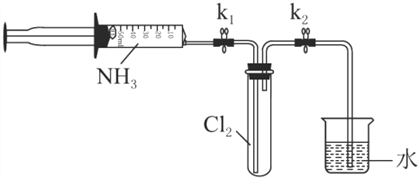
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是________。发生反应的化学方程式为________。
(4)再打开k2,可观察到的现象是________。
【答案】 A 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O(或B NH3·H2O
CaCl2+2NH3↑+2H2O(或B NH3·H2O![]() NH3↑+H2O) d→c→f→e→(d→c→)i 生成白烟,而后凝结在试管内壁,试管内黄绿色气体颜色逐渐变浅至褪去 3C12+8NH3=6NH4Cl+N2(或分开写:3C12+2NH3=6HCl+N2、HCl+NH3=NH4Cl) 烧杯中的水倒流进入试管中
NH3↑+H2O) d→c→f→e→(d→c→)i 生成白烟,而后凝结在试管内壁,试管内黄绿色气体颜色逐渐变浅至褪去 3C12+8NH3=6NH4Cl+N2(或分开写:3C12+2NH3=6HCl+N2、HCl+NH3=NH4Cl) 烧杯中的水倒流进入试管中
【解析】Ⅰ.氨气的制备
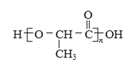
(1)实验室通常用氯化铵与氢氧化钙加热法制备氨气,氨气的发生装置可以选择上图中的A,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。也可以选择B装置加热浓氨水制备少量氨气,反应的化学方程式为NH3·H2O
CaCl2+2NH3↑+2H2O。也可以选择B装置加热浓氨水制备少量氨气,反应的化学方程式为NH3·H2O![]() NH3↑+H2O。
NH3↑+H2O。
(2)实验室通常用盛有碱石灰的干燥管来干燥氨气,氨气会污染空气,所以要设计一个尾气处理装置,因为氨气极易溶于水,常用一个小漏斗倒扣在水面上吸收氨气。实验室常用向下排空气法收集氨气,为防止尾气吸收装置中的水蒸气回流进集气瓶,可以在两者之间再加一个盛有碱石灰的干燥管。所以欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→d→c→f→e→(d→c→)i。
Ⅱ.氯气与氨气的反应
根据题中信息“常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气”可知,该反应中,氨气被氧化为氮气,氯气被还原为氯化氢,然后氯化氢再与氨气化合为氯化铵,反应的总化学方程式为3C12+8NH3=6NH4Cl+N2,所以若看到白烟产生,则证明有氯气从管道中泄漏。
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是生成白烟,而后凝结在试管内壁,试管内黄绿色气体颜色逐渐变浅至褪去。发生反应的化学方程式为3C12+8NH3=6NH4Cl+N2(或分开写:3C12+2NH3=6HCl+N2、HCl+NH3=NH4Cl)。
(4)由化学方程式可知,向试管中注入约3倍于氯气体积的氨气,反应前3体积的氯气反应后变为1体积的氮气,还剩余约1体积的氨气,反应后试管中的气体变少了,试管中的气压小于外界大气压,所以打开k2,可观察到的现象是烧杯中的水倒流进入试管中。

【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
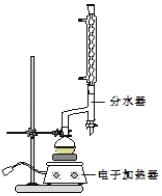
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.
【题目】(1)一定条件下,CO2与1.0mol·L-1NaOH溶液充分反应放出的热量如下表:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | X |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式为_____________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
温度 t/min | 0 | 40 | 80 | 120 | 160 |
甲(673K) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙(673K) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
②该反应的△H__________(填序号)
a.大于0 b.小于0 c.等于0 d.不能确定
③丙容器达到平衡时,NO的转化率为__________________。
(3)298K时,NH3·H2O的电离常数Kb=2×10-5,H2CO3的电离常数Kal=4×10-7,Ka2=4×10-11。在NH4HCO3溶液中,c(NH4+)__________c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。