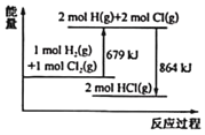
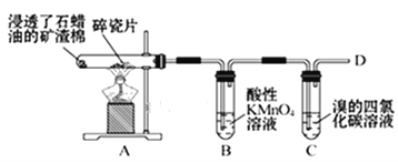
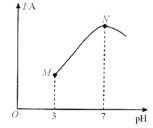
题目内容
【题目】已知某样品甲为仅含有三种元素的纯净物,不溶于水,能溶于稀盐酸,为探究其组成和性质,设计并完成如下实验:
①将 21.5g 该物质溶解于 600mL 1mol·L-1 盐酸中,得到黄色溶液乙,将溶液乙分成两等份;
②将其中一份加热蒸干、灼烧,得到 8.0g 红棕色固体丙;
③向另一份溶液中加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥得到白色沉淀 57.4g。请回答:
(1)写出实验③中检出离子的结构示意图_____。
(2)样品甲中所含的三种元素为_____。
(3)写出实验①中反应的离子方程式_____。
(4)写出实验②中,检出固体丙中所含阳离子的实验方法_____。(写出实验操作、现象及结论)。
【答案】 Fe 、Cl、O FeClO+2H+=Fe3++Cl-+H2O 取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+
Fe 、Cl、O FeClO+2H+=Fe3++Cl-+H2O 取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+
【解析】
由实验②知,生成Fe2O3 8.0g,说明含Fe3+的物质的量为![]() ,
,
由实验③知,生成AgCl的质量为 57.4g,物质的量为![]() 。
。
从而得出21.5g 样品中,含Fe原子0.8mol-0.6mol=0.2mol、Cl原子0.2mol,
含O原子![]()
故甲的化学式为FeClO
(1)写出实验③中检出Cl-离子的结构示意图 。答案为
。答案为
(2)样品甲中所含的三种元素为Fe、Cl、O。答案为:Fe、Cl、O
(3)写出实验①中反应的离子方程式FeClO+2H+=Fe3++Cl-+H2O。
答案为:FeClO+2H+=Fe3++Cl-+H2O
(4)写出实验②中,检出固体丙中所含阳离子Fe3+的实验方法为:取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+。
答案为:取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+