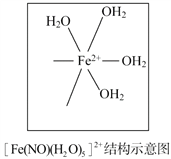
题目内容
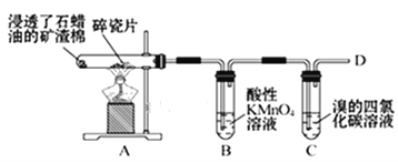
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平,某化学实验小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
(查阅资料可知:乙烯与酸性高锰酸钾溶液反应产生二氧化碳。)
(1)乙烯的结构式是___。
(2)B中实验现象:___。
(3)C中发生反应的化学方程式:__,反应类型:___。
(4)通过上述实验探究可知,除去乙烷中混有的乙烯,可以选择的试剂是___。
A.水 B.溴水
C.氢氧化钠溶液 D.酸性高锰酸钾溶液
(5)关于乙烯,下列说法中不正确的是___。
A.聚乙烯塑料可以用做食品包装袋
B.乙烯在一定条件下可以和水反应制乙醇
C.乙烯分子中所有原子不共面
D.乙烯是一种植物生长调节剂,可以延长果实和花朵的成熟期
【答案】![]() 酸性KMnO4溶液褪色 CH2=CH2+Br2→BrCH2—CH2Br 加成反应 B CD
酸性KMnO4溶液褪色 CH2=CH2+Br2→BrCH2—CH2Br 加成反应 B CD
【解析】
装置A中给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面,分解产生乙烯等物质,乙烯含有碳碳双键可以被酸性高锰酸钾,使装置B中的酸性高锰酸钾溶液褪色,乙烯可以可以溴发生加成反应,使装置C中溴的四氯化碳溶液褪色。
(1)乙烯的结构式为![]() ;
;
(2)乙烯含有碳碳双键可以被酸性高锰酸钾,使装置B中的酸性高锰酸钾溶液褪色;
(3)C中发生乙烯与溴的加成反应,方程式为CH2=CH2+Br2→BrCH2—CH2Br;
(4)乙烷和乙烯均不能溶于水,且均不能与NaOH溶液反应;乙烷不能与溴加成,也不能被酸性高锰酸钾氧化,但是乙烯被高锰酸钾氧化会生成二氧化碳成为新的杂质,而与溴水反应可以生成常温下为液态的1,2-二溴乙烷,所以可以用溴水除去乙烷中混有的乙烯,所以选B;
(5)A.聚乙烯塑料性质稳定且无毒,可以用做食品包装袋,A正确;
B.乙烯含有碳碳双键一定条件可以与水发生加成反应生成乙醇,B正确;
C.乙烯分子中碳原子为sp2杂化,杂化轨道为平面三角形结构,所以乙烯分子中所有原子共面,C错误;
D.乙烯具有催熟作用,可以缩短果实和花朵的成熟期,D错误;
综上所述,答案为CD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
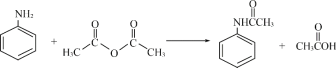
小学生10分钟应用题系列答案【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取 5.00mL 苯胺,倒入 100mL 锥形瓶中,加入 20mL 水,在旋摇下分批加入 6.00mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至 150mL 烧杯中,加入适量水配制成 80℃的饱和溶液,再加入过量 20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸 3~5min,趁热过滤,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品。
请回答:
(1)苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式____________________________________。
(2)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是____________。
A.反应快结束时的充分搅拌 B.旋摇下分批加入 6.0mL 乙酸酐
C.玻璃棒将块状物研碎 D.加 20mL 水
(3)在步骤②中对粗产品进行洗涤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b. 洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复 2~3 次。请选出正确的操作并排序_____。(操作可重复使用)
(4)加入过量 20%的水的目的是_____。
(5)下列关于步骤③说法不正确的是__________________________。
A. 活性炭吸附有色物质,可以提高产率
B. 冷却时,冰水浴冷却比室温冷却更易得到大颗粒晶体便于抽滤
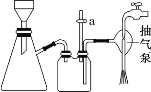
C. 抽滤用如图装置,为防止倒吸,结束时可先关闭抽气泵,后打开活塞 a
D. 洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手, 使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理
(6)最后测得纯乙酰苯胺固体 5.40g,该实验的产率为_____(保留三位有效数字)。