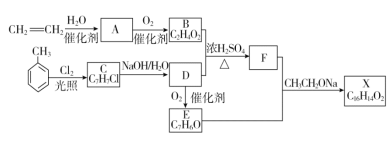
题目内容
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
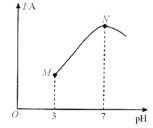
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
【答案】A
【解析】
A.醋酸溶液中加入氨水,二者反应生成醋酸铵和水,醋酸的电离出的氢离子浓度减小,对水的电离的抑制作用减弱,故正确;
B. 25℃时0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%,则根据电离平衡常数计算,醋酸电离平衡常数为![]() ,故错误;
,故错误;
C.N点溶液为中性,则有c(H+)=c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+ c(CH3COO-)分析,有c(CH3COO-)=c(NH4+),故错误;
D. 当滴入20 mL氨水时,溶液为等浓度的氨水和醋酸铵,溶液为碱性,根据电荷守恒c(NH4+)+c(H+)=c(OH-)+ c(CH3COO-)和c(H+)<c(OH-)分析,有c(CH3COO-)<c(NH4+),故错误。
故选A。

练习册系列答案
相关题目