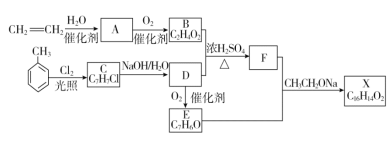
题目内容
【题目】已知断开 1mol Cl2(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )
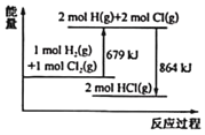
A.H2(g)+Cl2(g) = 2HCl(g) ΔH= + 185 kJ·mol-1
B.生成1mol H2(g)中的H-H键放出 121.5 kJ 能量
C.断开1mol HCl(g)中的H-C1键要吸收 864 kJ 能量
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH= + 92.5kJ·mol-1
Cl2(g) ΔH= + 92.5kJ·mol-1
【答案】D
【解析】
A.由图中可知,H2(g)+Cl2(g) = 2HCl(g) ΔH=(679-864) kJ·mol-1= -185 kJ·mol-1,A不正确;
B.生成1mol H2(g)中的H-H键放出699kJ-243kJ=456kJ能量,B不正确;
C.断开1mol HCl(g)中的H-C1键要吸收![]() kJ=432 kJ 能量,C不正确;
kJ=432 kJ 能量,C不正确;
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH=+
Cl2(g) ΔH=+![]() kJ·mol-1=+ 92.5kJ·mol-1,D正确;
kJ·mol-1=+ 92.5kJ·mol-1,D正确;
故选D。

练习册系列答案
相关题目