题目内容
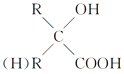
【题目】软性隐形眼镜可由聚甲基丙烯酸羟乙酯制成超薄镜片,其中聚甲基丙烯酸羟乙酯的合成路线如图所示:
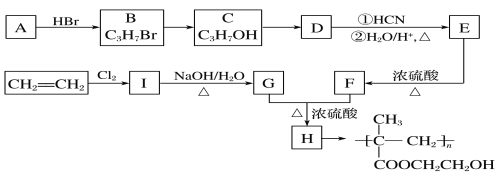
已知:
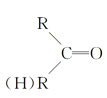 +HCN→
+HCN→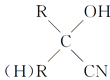
![]()
试回答下列问题:
(1)A、E的结构简式分别为A__________,E______________。
(2)写出下列反应的反应类型:A→B_____________,E→F____________。
(3)写出下列反应的化学方程式:
I→G__________________________________;
C→D___________________________________。
【答案】CH2=CHCH3 (CH3)2C(OH)COOH 加成反应 消去反应 CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl 2CH3CH(OH)CH3+O2
CH2OHCH2OH+2NaCl 2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
【解析】
CH2=CH2与Cl2发生加成反应得到I(CH2Cl-CH2Cl),CH2Cl-CH2Cl在NaOH的水溶液中发生取代反应得到G(HOCH2CH2OH);根据聚甲基丙烯酸羟乙酯的结构简式逆推其单体H的结构简式为CH2=C(CH3)COOCH2CH2OH,G与F在浓硫酸存在、加热条件下反应生成H,则F的结构简式为CH2=C(CH3)COOH;A与HBr反应得到B(C3H7Br),C3H7Br与NaOH的水溶液发生取代反应得到C(C3H7OH),C催化氧化得到D,D在HCN和H2O、H+ 作用下反应得到E,E在浓硫酸作用下加热发生反应得到F,结合题给已知和F的结构简式分析,A为CH3CH=CH2,B为CH3CHBrCH3,C为CH3CH(OH)CH3,D为CH3COCH3,E为(CH3)2C(OH)COOH,据此分析解答问题。
CH2=CH2与Cl2发生加成反应得到I(CH2Cl-CH2Cl),CH2Cl-CH2Cl在NaOH的水溶液中发生取代反应得到G(HOCH2CH2OH);根据聚甲基丙烯酸羟乙酯的结构简式逆推其单体H的结构简式为CH2=C(CH3)COOCH2CH2OH,G与F在浓硫酸存在、加热条件下反应生成H,则F的结构简式为CH2=C(CH3)COOH;A与HBr反应得到B(C3H7Br),C3H7Br与NaOH的水溶液发生取代反应得到C(C3H7OH),C催化氧化得到D,D在HCN和H2O、H+ 作用下反应得到E,E在浓硫酸作用下加热发生反应得到F,结合题给已知和F的结构简式分析,A为CH3CH=CH2,B为CH3CHBrCH3,C为CH3CH(OH)CH3,D为CH3COCH3,E为(CH3)2C(OH)COOH,
(1)由上述分析可知,A的结构简式为CH2=CHCH3,E的结构简式为(CH3)2C(OH)COOH,故答案为:CH2=CHCH3;(CH3)2C(OH)COOH;
(2)根据上述分析,A(CH2=CHCH3)与HBr发生加成反应得到B,E在浓硫酸作用下加热发生消去反应得到F(![]() ),故答案为:加成反应;消去反应;
),故答案为:加成反应;消去反应;
(3)I(CH2Cl-CH2Cl)在NaOH的水溶液中发生取代反应得到G(HOCH2CH2OH),I→G的化学方程式为CH2ClCH2Cl+2NaOH![]() HOCH2CH2OH+2NaCl;C与氧气发生催化氧化得到D(CH3COCH3),C→D的化学方程式为2CH3CH(OH)CH3+O2
HOCH2CH2OH+2NaCl;C与氧气发生催化氧化得到D(CH3COCH3),C→D的化学方程式为2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O,故答案为:CH2ClCH2Cl+2NaOH
2CH3COCH3+2H2O,故答案为:CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl;2CH3CH(OH)CH3+O2
CH2OHCH2OH+2NaCl;2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O。
2CH3COCH3+2H2O。

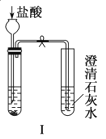
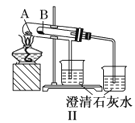
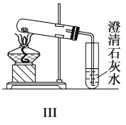
【题目】某探究性学习小组设计如图所示装置分别进行如下探究实验,请回答下列问题:
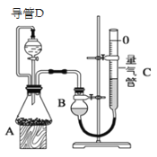
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | Na OH固体、浓氨水 | NH3 | |
Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是__________________________;
(2)实验Ⅱ中量气管中的液体最好是_______(填字母编号,下同)
A.NaOH溶液B.氨水C.煤油D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是________;
(3)①写出实验Ⅲ中涉及的离子反应方程式_________________________;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是________________,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 376.6mL |
② | 1.0g | 10.0mL | 364.7mL |
③ | 1.0g | 10.0mL | 377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为_______________。
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D