题目内容
【题目】(1)以甲烷、氧气为原料,KOH溶液作为电解质构成燃料电池,总反应式为____,如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:____;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH﹣物质的量浓度为0.01molL﹣1(25℃下测定),则理论上消耗氧气的体积为____mL(标况下)。
(2)用铂电极电解CuSO4溶液,当C(Cu2+)降至原来的一半时停止通电,则加入下列物质中的__ (填序号)物质能使溶液恢复成原来浓度;
A.CuO B.Cu(OH)2 C.Cu D.H2O
电解后电解质溶液的pH值__(填“增大”“减小”或“不变”);写出电解总离子方程式____。
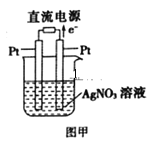
(3)用Pt作电极电解硝酸银溶液,如图甲所示,则左边Pt电极名称是__;发生的电极反应式为__。
【答案】CH4+2O2+2KOH=K2CO3+3H2O 2Cl--2e-=Cl2↑ 56mL A 减小 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 阴极 Ag++e-=Ag
2Cu+O2↑+4H+ 阴极 Ag++e-=Ag
【解析】
(1)甲烷、氧气、KOH构成燃料电池,相当于燃料在氧气中燃烧,其总反应式为CH4+2O2+2KOH=K2CO3+3H2O;如果以该燃料电池为电源,石墨作两极电解饱和食盐水,根据电解原理,阳极与电池的正极相连,失电子化合价升高,阳极电极反应式为2Cl--2e-=Cl2↑;电解饱和食盐水总反应是2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,根据转移电子数目相等,建立关系式为O2~4e-~4NaOH,消耗氧气的物质的量为1L×0.01mol·L-1/4=0.0025mol,标准状况下,V(O2)=0.0025mol×22.4L·mol-1=0.056L,合56mL;
2NaOH+H2↑+Cl2↑,根据转移电子数目相等,建立关系式为O2~4e-~4NaOH,消耗氧气的物质的量为1L×0.01mol·L-1/4=0.0025mol,标准状况下,V(O2)=0.0025mol×22.4L·mol-1=0.056L,合56mL;
(2)用惰性材料作电极,总电极反应式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,当c(Cu2+)降至原来的一半时停止通电,脱离体系的是Cu和O2,因此恢复到电解前的状态需要加入物质是CuO,故A正确;根据总电极反应式,产生硫酸,溶液的pH减小;总电极的离子方程式为2Cu2++2H2O
2Cu+O2↑+2H2SO4,当c(Cu2+)降至原来的一半时停止通电,脱离体系的是Cu和O2,因此恢复到电解前的状态需要加入物质是CuO,故A正确;根据总电极反应式,产生硫酸,溶液的pH减小;总电极的离子方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
(3)根据电子转移方向,右侧Pt为阳极,左侧Pt为阴极,根据电解原理,阳离子在阴极上得电子,即电极反应式为Ag++e-=Ag。