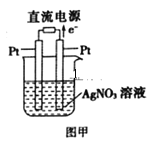
题目内容
【题目】25 ℃时,用pH试纸测得0.1 mol·L-1 NaNO2溶液的pH>7.
(1)NaNO2溶液pH>7的原因是(用离子方程式表示) ________,NaNO2溶液中c(HNO2)=________ (用溶液中其他离子的浓度关系式表示).
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_______ (填“大于”或“小于”)NaNO2的水解程度.该混合溶液中离子浓度由大到小的顺序是______________.
(3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_________7,c(Na+) __________c(NO2-)(填“大于”或“小于”).
【答案】NO2-+H2O![]() HNO2+OH- c(OH-)-c(H+) 大于 c(NO2-)>c(Na+)>c(H+)>c(OH-) 小于 小于
HNO2+OH- c(OH-)-c(H+) 大于 c(NO2-)>c(Na+)>c(H+)>c(OH-) 小于 小于
【解析】
(1)NO2-发生了水解,显碱性,因而pH>7,其离子方程式为NO2-+H2O![]() HNO2+OH-,根据NaNO2溶液质子守恒,可得c(H+)+c(HNO2)=c(OH-),因而c(HNO2)= c(OH-)- c(H+)。
HNO2+OH-,根据NaNO2溶液质子守恒,可得c(H+)+c(HNO2)=c(OH-),因而c(HNO2)= c(OH-)- c(H+)。
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,得到等浓度的HNO2和NaNO2的混合液,所得溶液的pH<7,说明HNO2的电离程度大于NO2-的水解程度。HNO2的电离程度较大,得到较多的NO2-,因而其浓度大于Na+的浓度,溶液显酸性,说明c(H+)>c(OH-),另外水解和电离是微弱的,可知Na+的浓度大于H+的浓度,因而c(NO2-)>c(Na+)>c(H+)>c(OH-)。
(3)常温下,pH=3的HNO2溶液,因HNO2是弱酸,c(HNO2)>10-3mol/L,pH=11的NaOH溶液,c(NaOH)=10-3mol/L,等体积混合,易知酸过量,因而溶液显酸性,pH<7,根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+ c(NO2-),c(H+)>c(OH-),所以c(Na+)< c(NO2-)。

【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
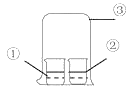
①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
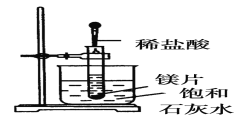
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
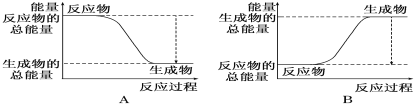
II:从能量变化的角度研究反应:2H2+O2=2H2O。
(1)如图能正确表示该反应中能量变化的是_________。
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。