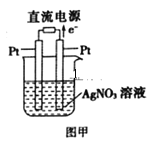
��Ŀ����
����Ŀ��A��B��C��D��E��F����Ԫ�أ����ǵĺ˵������С��18����ԭ��������������֪��A��C��F����ԭ�ӵ�����㹲��11�����ӣ���������Ԫ�ص�����������ˮ����֮���������ܷ�Ӧ���������κ�ˮ��DԪ��ԭ�ӵ������������ȴ�����������4����EԪ��ԭ�ӵĴ�����������������������3������ش��������⣺
(1)д��D��Ԫ�ط���_________��E������������ˮ����ķ���ʽ__________��
(2)����BԪ�صļ����ӽṹʾ��ͼ_____________��
(3)������FԪ�ص�һ�ֺ��ص�������Ϊ18��д���ú��صı�ʾ����_____________��
(4)C��FԪ������������ˮ���ﷴӦ�����ӷ���ʽ����Ϊ��_____________��
(5)����C�ڸ���������������������Ӧ���÷�Ӧ�������ں������죬��д���÷�Ӧ�Ļ�ѧ����ʽ____��
���𰸡�Si H3PO4 ![]()
![]() 3H++Al(OH)3=Al3++3H2O 2Al + Fe2O3
3H++Al(OH)3=Al3++3H2O 2Al + Fe2O3 ![]() 2Fe + Al2O3
2Fe + Al2O3
��������
DԪ�ص������������ȴ�����������4��Dԭ��ֻ����3�����Ӳ㣬ԭ������������Ϊ8-4=4����DΪSiԪ�أ�EԪ��ԭ�Ӵ�����������������������3��E��ԭ����������D��Eԭ����3�����Ӳ㣬����������Ϊ8-3=5����EΪ��Ԫ�أ�A��C��F����Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ������AlԪ�أ�������������ǿ�ᡢǿ�����NaԪ�أ���AΪNa��CΪAl������ԭ������㹲��11�����ӣ���E������������Ϊ11-1-3=7����FΪClԪ�أ����ԭ��������֪BΪMg���ݴ˽��
(1)���ݷ�����֪DΪSi��EΪP��������������Ӧ��ˮ����ΪH3PO4��
(2)BΪMgԪ�أ�Ϊ12��Ԫ�أ�ʧȥ���������γ�Mg2+���ṹʾ��ͼΪ![]() ��
��
(3)FΪClԪ�أ�������=������+����������ú��ص�������=18+17=35�����Է���Ϊ![]() ��
��
(4)CΪAl������������ˮ����ΪAl(OH)3��FΪCl��������������ˮ����ΪHClO4�����߷�Ӧ���ӷ���ʽΪ3H++Al(OH)3=Al3++3H2O��
(5)Al��Fe2O3�ڸ��������·�Ӧ����ʽΪ2Al + Fe2O3 ![]() 2Fe + Al2O3��
2Fe + Al2O3��