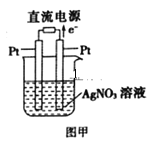
��Ŀ����
����Ŀ��I.��ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ2CH3OH+3O2+4KOH=2K2CO3+6H2O

��ش�
(1)�׳���________��ͨ��O2�ĵ缫��Ϊ________�����缫��ӦʽΪ_____________��
(2)�ҳ���________��A�缫����Ϊ________�����缫��ӦʽΪ________���ҳ��е��ܷ�Ӧ���ӷ���ʽΪ_______________________________����Һ��pH________(����������������С������������)��
(3)���ҳ���B(Ag)������������5.40gʱ���׳�������������O2_______mL(��״����)��
II. (4)ͼI����ʳ��ˮ�����Һ��������ѵ���һ��ԭ��ͼ��NO��������������������������ΪNO3-��β��������������Һ���պ�����������С������ܶȺ���ҺpH�������ѵ���Ӱ����ͼII��

ͼI ͼII
�ٴ������β���У�һ�����е����嵥����___________���ѧʽ����
����Һ��pH��NO��ȥ����Ӱ���ԭ����___________��
���𰸡�ԭ��� �� O2��2H2O��4e��=4OH�� ���� �� 4OH����4e��=O2����2H2O 4Ag����2H2O![]() 4Ag��O2����4H�� ��С 280 H2 ����������������������������ǿ
4Ag��O2����4H�� ��С 280 H2 ����������������������������ǿ
��������
��1����Ϊԭ��أ�ͨ��������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫����ʽΪO2+2H2O+4e-�T4OH-��
�𰸣�ԭ��أ�����O2+2H2O+4e-�T4OH-��
��2����Ϊ���أ�A��ԭ�������������Ϊ���ص�����������������Ӧ���缫����ʽΪ4OH--4e-�TO2��+2H2O�������������Һ��������������������������������ܷ�ӦʽΪ4Ag����2H2O![]() 4Ag��O2����4H��������H+������ҺpH��С��
4Ag��O2����4H��������H+������ҺpH��С��
�𰸣����أ�����4OH--4e-�TO2��+2H2O��4Ag����2H2O![]() 4Ag��O2����4H�� ����С
4Ag��O2����4H�� ����С
��3���ҳ���B��������ԭ��Ӧ���缫����ʽΪAg++e-=Ag��n��Ag��=![]() =0.05mol����ת�Ƶ���0.05mol���ɵ缫����ʽO2+2H2O+4e-�T4OH-��֪����
=0.05mol����ת�Ƶ���0.05mol���ɵ缫����ʽO2+2H2O+4e-�T4OH-��֪����![]() =0.0125mol��������V��O2��=0.0125mol��22.4L/mol=0.28L=280mL��
=0.0125mol��������V��O2��=0.0125mol��22.4L/mol=0.28L=280mL��
�𰸣�280
II. (4)���������֪�� 2NaCl+2H2O![]() 2NaOH+H2��+Cl2����3Cl2+8OH-+2NO=2NO3��+4H2O +6Cl�����������β���У�һ�����е����嵥����H2������ͼ���֪��pHԽС��ȥ����Խ�ߣ�������Ϊ����������������������������ǿ��
2NaOH+H2��+Cl2����3Cl2+8OH-+2NO=2NO3��+4H2O +6Cl�����������β���У�һ�����е����嵥����H2������ͼ���֪��pHԽС��ȥ����Խ�ߣ�������Ϊ����������������������������ǿ��
�𰸣�H2 ������������������������������ǿ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����.���Ʊ������ǻ�ѧʵ���һ�ֳ��÷������±���ijѧϰС���о������ʵ���Ũ�ȵ�ϡ�����п��Ӧ��ʵ�����ݣ������������ݣ��ش��������⣺
��� | ��������/mL | п������/g | п����״ | �¶�/�� | ��ȫ�������ʱ��/s | ��������п������/g |
1 | 50.0 | 2.0 | ��Ƭ | 25 | 100 |
|
2 | 50.0 | 2.0 | ���� | 25 | 70 |
|
3 | 50.0 | 2.0 | ���� | 35 | 35 |
|
4 | 50.0 | 2.0 | ��ĩ | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | ��ĩ | 35 | 30 |
|
(1)��ʵ����ʵ��2��ʵ��3����______________________________�Է�Ӧ������Ӱ�졣
(2)��������ʵ��1��ȫ��ͬ������������Ӧ�����еμ���������ͭ��Һ�����ַ�Ӧ�������Լӿ졣ԭ����________________________________________________��
��.ij�¶�ʱ����5L�������У�X��Y��Z ������������ʵ�����ʱ��ı仯������ͼ��ʾ����ͨ������ش��������⣺

(3)��Ӧ��ʼ��2 min��Y��ƽ����Ӧ����_______mol��L-1min-1 ��
(4)��Ӧ��ʼ��2 min��X��ת����________��
(5)д�� X��Y��Z �ķ�Ӧ����ʽ__________________________________________��