题目内容
【题目】下图是硫酸试剂瓶标签上的内容:
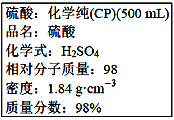
(1)该硫酸的物质的量浓度是____________________ molL-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL4.6 molL-1的稀硫酸,则需要取________mL的该硫酸来进行配制实验。
(3)将上述硫酸进行稀释的实验操作为________________________。
(4)用上述硫酸配制240mL4.6 molL-1的稀硫酸,实验仪器有:①50mL量筒 ②100mL量筒 ③托盘天平 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶,实验时使用选用仪器的先后顺序为__________。
(5)下列操作会使配制的溶液浓度偏高的是_________________(填下列选项的编号字母)。
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.摇匀后,液面下降,补充水 D.定容时俯视刻度线
【答案】18.4 62.5 将浓硫酸沿器壁缓慢注入水中,并不断地用玻璃棒搅拌溶液 ②⑦④⑤⑥ D
【解析】
本题考查配制一定物质的量浓度的溶液,(1)利用c=1000ρw/M,代入数值,c=1000×1.84×98%/98mol·L-1=18.4mol·L-1;(2)实验室没有240mL的容量瓶,因此应用250mL的容量瓶,稀释溶液,溶质物质的量或质量保持不变,因此需要硫酸的体积250×10-3×4.6/18.4L=62.5×10-3L,合62.5mL;(3)浓硫酸的密度大于水的密度,且浓硫酸遇水放出大量热,因此稀释硫酸的操作是将浓硫酸沿器壁缓慢注入水中,并不断地用玻璃棒搅拌溶液;(4)配制溶液的步骤是量取、稀释、冷却、转移、洗涤、振荡、定容、摇匀,因为量取62.5mL的液体,因此使用100mL的量筒,使用仪器的先后顺序是100mL量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,顺序是②⑦④⑤⑥;(5)分析配制一定物质的量浓度溶液的误差,根据c=n/V=m/MV,A、没有将洗涤液转移到容量瓶中,造成容量瓶中溶液的质量或物质的量减少,即所配溶液浓度偏低,故A错误;B、转移过程中造成液体溅出,容量瓶中溶液的质量或物质的量减少,即所配溶液浓度偏低,故B错误;C、摇匀后,液面下降,补充水,相当于对原来溶液进行稀释,浓度偏低,故C错误;D、定容时俯视刻度线,溶液体积偏小,浓度偏高,故D正确。

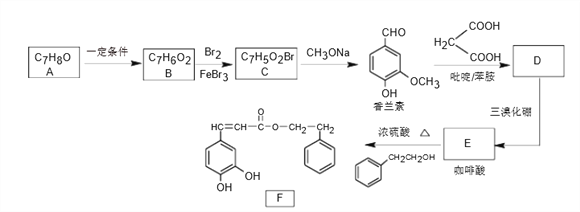
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3·H2O吸收。
已知2NH3·H2O (aq) + H2SO4(aq)==(NH4)2SO4(aq)+ 2H2O(l) △H=-24.2kJ/mol,中和热△H=-57.3 kJ/mol则1mol NH3·H2O理论上完全电离时需要吸收的热量为________。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式_______。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4mol SO2,发生SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。
SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。

①a、c两点反应速率大小关系: v(a) ___v(c)。(填“>”、“<” 或“=”)
②温度为T2时从反应开始经过2min 达到b点,用SO3表示这段时间的反应速率为______,此温度下该反应的平衡常数为_______。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率_______(填“增大”、“减小”或“不变”).
③NO2的转化率随温度升高先增大后减小的原因是____________。