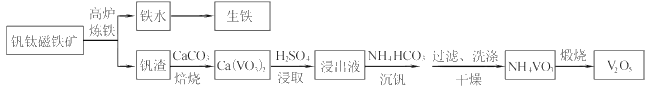
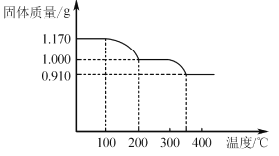
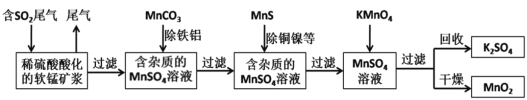
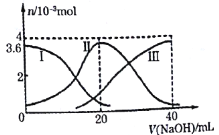
题目内容
【题目】CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO310H2O的质量为_______ g(保留2位小数)。
(2)CoCl2xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________。
【答案】5.72 6 Co2O3
【解析】
(1)滤液与洗涤液与盐酸反应生成气体是因为溶液中有过量的Na2CO3,Na2CO3+2HCl =2NaCl +CO2 ↑+H2O,n(Na2CO3)=![]() ==0.01mol,CoCO3的物质的量:
==0.01mol,CoCO3的物质的量:![]() =0.01mol,所以根据CO32-守恒可知总Na2CO3·10H2O的物质的量是0.01mol+0.01mol=0.02mol,固体混合物中Na2CO310H2O的质量为286g·mol-1×0.02mol=5.72g;
=0.01mol,所以根据CO32-守恒可知总Na2CO3·10H2O的物质的量是0.01mol+0.01mol=0.02mol,固体混合物中Na2CO310H2O的质量为286g·mol-1×0.02mol=5.72g;
故答案为:5.72g;
(2)CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,(59+71+18x)×0.01mol+5.72g=8.100g,x=6;
故答案为:6;
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,其中n(Co)=0.01mol,n(O)=![]() =0.015mol,n(Co):n(O)=2:3,该氧化物属离子晶体,该晶体的化学式为Co2O3;
=0.015mol,n(Co):n(O)=2:3,该氧化物属离子晶体,该晶体的化学式为Co2O3;
故答案为:Co2O3。

练习册系列答案
相关题目