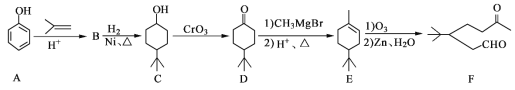
题目内容
【题目】将Na2S 溶液逐滴加入等物质的量浓度的FeCl3溶液中,发生反应:2Fe3+ + S2- → 2Fe2+ + S ↓;将FeCl3溶液逐滴加入等物质的量浓度的Na2S溶液中,发生反应:2Fe3+ + 3S2- → Fe2S3↓ 。则以下叙述错误的是
A.Fe3+在酸性环境中氧化性较强B.S2-在碱性环境中还原性较强
C.相同温度下Fe(OH)3的溶解度比Fe2S3大D.往FeCl3溶液中通入H2S,有硫析出
【答案】B
【解析】
A.FeCl3溶液中Fe3+水解,Fe3++3H2O![]() Fe(OH)3+3H+且将Na2S 溶液逐滴加入等物质的量浓度的FeCl3溶液中,发生反应:2Fe3++S2-═2Fe2++S↓由此看出Fe3+在酸性环境中氧化性较强,故A正确;
Fe(OH)3+3H+且将Na2S 溶液逐滴加入等物质的量浓度的FeCl3溶液中,发生反应:2Fe3++S2-═2Fe2++S↓由此看出Fe3+在酸性环境中氧化性较强,故A正确;
B.Na2S 溶液中S2-水解,S2-+H2O![]() HS-+OH-(主要),HS-+H2O
HS-+OH-(主要),HS-+H2O![]() H2S+OH-(少量),将FeCl3溶液逐滴加入等物质的量浓度的Na2S溶液中,发生反应:2Fe3++3S2-═Fe2S3↓,没有生成硫单质,S2-在碱性环境中还原性较弱,故B错误;
H2S+OH-(少量),将FeCl3溶液逐滴加入等物质的量浓度的Na2S溶液中,发生反应:2Fe3++3S2-═Fe2S3↓,没有生成硫单质,S2-在碱性环境中还原性较弱,故B错误;
C.由于将FeCl3溶液逐滴加入等物质的量浓度的Na2S溶液中,发生反应:2Fe3++3S2-═Fe2S3↓,不生成Fe(OH)3,说明相同温度下Fe(OH)3的溶解度比Fe2S3的大,故C正确;
D.往FeCl3溶液中通入H2S,硫离子被铁离子氧化成硫单质,有硫析出,故D正确;
故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目