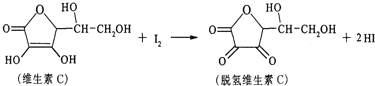
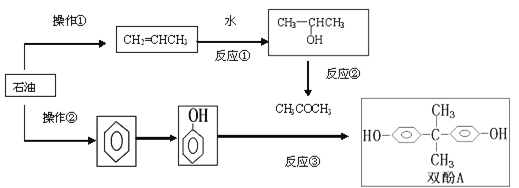
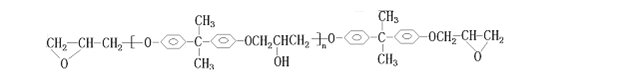
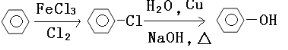题目内容
【题目】常温下,向20mL0.2mol·L-1的H2B溶液中滴加0.2mol·L-1的NaOH溶液过程中,有关微粒的物质的量变化如图所示,下列说法不正确的是( )
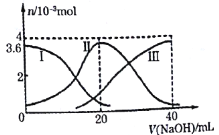
A.I表示H2B,Ⅱ代表HB-、Ⅲ代表B2-
B.当c(Na+)=2c(B2-)+c(HB-)时,溶液呈中性
C.初始时H2B第一级电离的电离度为90%
D.V(NaOH)=20mL时:c(Na+)>c(HB-)>c(B2-)>c(H2B)
【答案】C
【解析】
由图像可知溶液中存在H2B、HB—、B2-三种微粒,所以H2B为二元弱酸。Ⅰ为H2B的变化曲线;Ⅱ为HB-的变化曲线;Ⅲ为B2-的变化曲线。
A. I表示H2B,Ⅱ代表HB-、Ⅲ代表B2-,A正确;
B. 根据电荷守恒c(Na+)+ c(H+)= 2c(B2-) + c(OH-)+ c(HB-),当c(Na+)=2c(B2-)+c(HB-)时,溶液中c(H+)=c(OH-),溶液呈中性,B正确;
C. 该溶液中H2B总物质的量=0.2mol/L×0.02L=0.004mol,由坐标图可知,氢氧化钠未滴加时H2B为0.0036mol,则初始时H2B第一级电离的电离度为![]() ×100%=10%,C错误;
×100%=10%,C错误;
D.V(NaOH)=20mL时,恰好完全生成NaHB,根据图像可知c(Na+)>c(HB-)>c(B2-)>c(H2B),D正确;
答案选C。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目