题目内容
12.对于一定体积和条件下的可逆反应:N2+3H2?2NH3,能说明反应已达平衡状态的是( )| A. | 百分组成 NH3%=N2% | B. | 气体的密度不变 | ||
| C. | 压强不变 | D. | c(H2):c(N2):c(NH3)=3:1:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、百分组成不变,而不是 NH3%=N2%,故A错误;
B、体积不变,反应体系都是气体,所以密度始终不变,故B错误;
C、压强不变,说明气体的物质的量不变,反应达平衡状态,故C正确;
D、当体系达平衡状态时,H2、N2、NH3的物质的量之比可能为3:1:2,也可能不是3:1:2,与各物质的初始浓度及转化率有关,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
2.常温下,在下列溶液中发生如下反应:
①16H++10Z-+2XO${\;}_{4}^{-}$═2X2++5Z2+8H2O
②2A2++B2═2A3++2B- ③2B-+Z2═B2+2Z-
由此判断下列说法正确的是( )
①16H++10Z-+2XO${\;}_{4}^{-}$═2X2++5Z2+8H2O
②2A2++B2═2A3++2B- ③2B-+Z2═B2+2Z-
由此判断下列说法正确的是( )
| A. | 反应Z2+2A2+═2A3++2Z-不能进行 | |
| B. | Z元素在①③反应中均被氧化 | |
| C. | 氧化性由弱到强的顺序是XO${\;}_{4}^{-}$、Z2、B2、A3+ | |
| D. | 还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
20.下列吸热反应可能是自发进行的是( )
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) | B. | (NH4)2CO3(s)═NH4HCO3(g)+NH3(g) | ||
| C. | 2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g) | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe |
7.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法不正确的是( )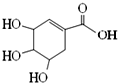

| A. | 分子式为C7H10O5 | |
| B. | 分子中含有3种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
17.一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2+3H2?2NH3,2min时测得剩余N2为1mol,此时化学反应速率表示不正确的是( )
| A. | υ(N2)=0.25mol/(L•min) | B. | υ(H2)=0.75mol/(L•min) | ||
| C. | υ(NH3)=1mol/(L•min) | D. | υ(NH3)=0.5mol/(L•min) |
4.下列说法正确的是( )
| A. | NH3的摩尔质量为17g | |
| B. | 48gO3含有的臭氧分子数为6.02×1023 | |
| C. | 1mol•L-1NaCl溶液中含1molNa+ | |
| D. | 标准状况下,1molH2O的体积为22.4 L |
1.学习化学可以防止走入生活和学习的误区.你认为下列说法不正确的是( )
| A. | 水银不是银,而是金属汞 | B. | 纯碱不是碱,而是盐 | ||
| C. | 干冰不是冰,而是固体二氧化碳 | D. | 烧碱不是碱,而是一种常见的盐 |
2.按原子序数递增的顺序(稀有气体除外),对第三周期元素性质的描述正确的是( )
| A. | 原子半径和离子半径均减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 非金属气态氢化物稳定性逐渐增强 | |
| D. | 单质的熔点降低 |
