题目内容
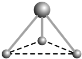
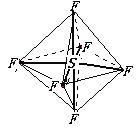
【题目】六氟化硫分子呈正八面体(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是( )
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.S—F键是 σ键,且键长、键能都相等
D.六氟化硫分子中只含极性键
【答案】CD
【解析】
A. SF6中F为-1价,则S为+6价,S元素不能再失电子,所以不能被氧化,不能和氧气反应生成SO2,故A错误;
B. S原子最外层电子全都参与成键,则其原子最外层电子为12个,不是8电子稳定结构,故B错误;
C. 六氟化硫分子中的S-F键都是σ键,为正八面体结构,键长、键能都相等,故C正确;
D. 硫氟键为极性共价键,六氟化硫分子中只含极性键,故D正确;
正确答案是CD。

练习册系列答案
相关题目