题目内容
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对
与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强。 请仔细阅读上述材料,回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO43-_____________________________; PCl5_____________________。
(2) 有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
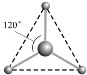 __________________;
__________________;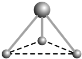 __________________。
__________________。
(3) 按要求写出第二周期非金属元素构成的中性分子的化学式:平面三角形分子___________,三角锥形分子___________,四面体形分子_____________。
(4) 下列一组微粒中键角由大到小顺序排列为____________________(用编号填写)
①HCN ②SiF4 ③SCl2 ④CO32- ⑤H3O+
【答案】正四面体 三角双锥 CH3+ CH3- BF3 NF3 CF4 ①④②⑤③
【解析】
(1) PO43-磷酸根离子价层电子对个数为4,且不含孤电子对,为sp3杂化类型;PCl5价层电子对数为5,且不含孤电子对,是sp3d杂化;
(2)根据分子的空间构型、杂化类型以及价层电子对数结合粒子中均含有1个碳原子和3个氢原子来分析判断;
(3)由第二周期非金属元素构成的中性分子,第二周期元素为中心原子,如果是平面形分子,则通过sp2杂化形成中性分子;如果是三角锥型分子,则通过sp3杂化形成中性分子,且价层电子对个数是4,含有一个孤电子对;如果是正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,据此分析解答;
(4)根据价层电子对互斥模型可以推出①HCN;②SiF4;③SCl2;④CO32-; ⑤H3O+的空间构型和键角。
(1)PO43-磷酸根离子价层电子对个数为4,且不含孤电子对,为sp3杂化类型,空间构型为正四面体形;PCl5价层电子对数为5,且不含孤电子对,是sp3d杂化,中心是5个电子对,呈三角双锥;
(2)第一种微粒的空间结构为平面三角形,则碳原子为sp2杂化,中心碳原子无孤电子对,因此价层电子对数3,化学式为CH3+,第二种微粒的空间结构为三角锥形,则碳原子为sp3杂化,中心碳原子有1个孤电子对,因此价层电子对数4,化学式CH3-,故答案为:CH3+;CH3-;
(3)由第二周期非金属元素构成的中性分子,第二周期元素为中心原子,通过sp2杂化形成中性分子,是平面形分子,该类型分子有BF3;第二周期元素为中心原子,通过sp3杂化形成中性分子,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,该类型分子有NF3;如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,该类型分子有CF4,故答案为:BF3;NF3;CF4;
(4)①HCN为直线形分子(中心碳原子采取sp 1 杂化),键角180°;②SiF 4 为正四面体结构,键角为109.5°;③SCl 2 为V形结构,键角接近90°;④CO 32- 为平面形结构,键角120°;⑤H 3O+ 为三角锥形结构,小于109.5°,但大于90°。所以键角由大到小顺序排列为①④②⑤③。

 阅读快车系列答案
阅读快车系列答案