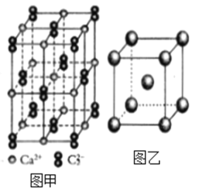
题目内容
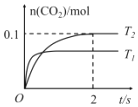
【题目】综合处理工业“三废”,有利于保护环境、节约资源。反应 2NO(g)+2CO(g)2CO2(g)+N2(g),可减少汽车尾气中污染物的排放,在 2L 密闭容器中发生该反应时,n(CO2)随温度 T 和时间 t 的变化曲线如图所示。
(1)该反应的平衡常数表达式为K=______,若升高温度,平衡常数 K 值______(填“增加”“减小”或“不变”),说明理由______;
(2)在 T2温度下, 0~2s 内的平均反应速率 v(N2)=______;
(3)工业废水的处理方法有很多,使用 Fe2(SO4)3 处理废水,酸性废水中的悬浮物很难沉降除去,结合离子方程式用平衡移动原理解释原因______,干法制备多功能水处理剂高铁酸钠(Na2FeO4)的反应原理为:2FeSO4+6Na2O2→2Na2FeO4+Na2O+2Na2SO4+O2↑,该反应的氧化剂为______;
(4)采用氨碱法生产纯碱会产生大量的副产品______,用化学方程式表示产生副产品的原因______。
【答案】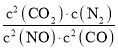 减小 由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小 0.0125mol/(Ls) Fe3++3H2OFe(OH)3+3H+,废水中的酸(H+)抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力 Na2O2 CaCl2 Ca(OH)2+2NH4Cl=CaCl2+NH3↑+2H2O
减小 由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小 0.0125mol/(Ls) Fe3++3H2OFe(OH)3+3H+,废水中的酸(H+)抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力 Na2O2 CaCl2 Ca(OH)2+2NH4Cl=CaCl2+NH3↑+2H2O
【解析】
(1)反应的平衡常数等于生成物浓度幂积与反应物浓度幂积之比;根据速率变化或“先拐先平,数值大”规则可知T1>T2,由图可知,升高温度,n(CO2)减小;
(2)根据v=![]() =
=![]() 计算v(CO2),再根据反应计量关系计算v(N2);
计算v(CO2),再根据反应计量关系计算v(N2);
(3)Fe2(SO4)3水解的离子反应为Fe3++3H2OFe(OH)3+3H+,酸性废水中的H+会导致Fe2(SO4)3不能形成胶体或者胶体非常少;氧化还原反应中氧化剂发生还原反应、元素的化合价降低,据此分析解答;
(4)氨碱法工艺中产生大量CaCl2的化学方程式为:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O,据此分析解答。
2NH3↑+CaCl2+2H2O,据此分析解答。
![]() (1)反应2NO(g)+2CO(g)2CO2(g)+N2(g)的平衡常数K=
(1)反应2NO(g)+2CO(g)2CO2(g)+N2(g)的平衡常数K=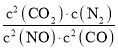 ,根据速率变化或“先拐先平,数值大”规则可知T1>T2,由n(CO2)随温度T和时间t的变化曲线图可知,升高温度,n(CO2)减小,即升高温度,平衡逆向移动,正反应为放热反应,所以平衡常数K值减小,故答案为:
,根据速率变化或“先拐先平,数值大”规则可知T1>T2,由n(CO2)随温度T和时间t的变化曲线图可知,升高温度,n(CO2)减小,即升高温度,平衡逆向移动,正反应为放热反应,所以平衡常数K值减小,故答案为: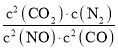 ;减小;由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小;
;减小;由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小;
(2)由图可知,v(CO2)=![]() =
=![]() =0.025mol/(Ls),反应为2NO(g)+2CO(g)2CO2(g)+N2(g),则v(N2)=v(CO2)=×0.025mol/(Ls)=0.0125mol/(Ls),故答案为:0.0125mol/(Ls);
=0.025mol/(Ls),反应为2NO(g)+2CO(g)2CO2(g)+N2(g),则v(N2)=v(CO2)=×0.025mol/(Ls)=0.0125mol/(Ls),故答案为:0.0125mol/(Ls);
(3)Fe2(SO4)3中Fe3+水解的离子方程式为Fe3++3H2OFe(OH)3+3H+,酸性废水中H+抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力,因此不能吸附悬浮物沉降而除去;反应2FeSO4+6Na2O2→2Na2FeO4+Na2O+2Na2SO4+O2↑中,Fe的化合价由+2→+6,发生氧化反应,即FeSO4为还原剂,Na2O2中O的化合价-1→-2或0,所以Na2O2既是氧化剂,又是还原剂,故答案为:Fe3++3H2OFe(OH)3+3H+,废水中的酸(H+)抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力;Na2O2;
(4)氨碱法工艺中,为提高氨气的利用率,常在母液中加入生石灰CaO,反应为CaO+H2O=Ca(OH)2,加热条件下Ca(OH)2和NH4Cl![]() 2NH3↑+CaCl2+2H2O,同时得到大量副产品CaCl2,故答案为:CaCl2;2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,同时得到大量副产品CaCl2,故答案为:CaCl2;2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O。
2NH3↑+CaCl2+2H2O。

【题目】(1)已知常温时,a mol/L醋酸与0.1mol/LNaOH溶液等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
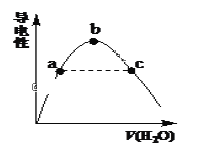
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是_____(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________