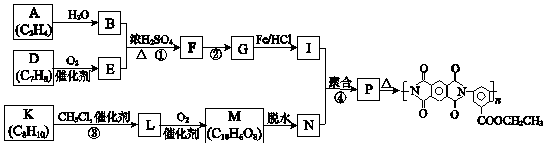
题目内容
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
实验 | 操作 | 现象 |
I | 常温下将MnO2和12molL﹣1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4molL﹣1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是 .
②II中发生了分解反应,反应的化学方程式是 .
③III中无明显现象的原因,可能是c(H+)或c(Cl﹣)较低,设计实验(图1)IV进行探究: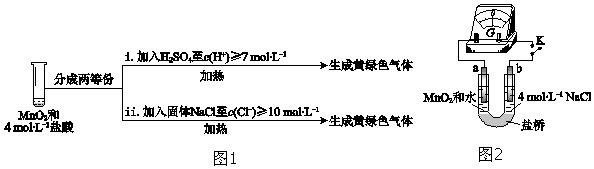
将实验 III、IV作对比,得出的结论是;将 i、ii作对比,得出的结论是 .
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是 .
(2)研究盐酸能否被氧化性酸氧化. ①烧瓶中放入浓H2SO4 , 通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3 , 试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2 .
实验 | 操作 | 现象 |
I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
III | … | … |
通过实验 I、II、III证明混合气体中含有Cl2 , III的操作是 .
由上述实验得出:盐酸能否被氧化与氧化剂的种类、有关.
【答案】
(1)MnO2+4HCl═MnCl4+2H2O; MnCl4═Cl2↑+MnCl2; III中没有明显现象的原因是c(H+)、c(Cl﹣)较低,需要增大到一定浓度才能被MnO2氧化; MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl﹣); HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强
(2)不能;将湿润的淀粉KI试纸伸入纯净的NO2中; c(Cl﹣)、c(H+)
【解析】解:(1)①常温下将MnO2和12molL﹣1浓盐酸混合,溶液呈浅棕色,略有刺激性气味,已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,结合元素化合价不变书写化学方程式MnO2+4HCl═MnCl4+2H2O,
所以答案是:MnO2+4HCl═MnCl4+2H2O;
②将 I中混合物过滤,加热滤液生成大量黄绿色气体为氯气,说明分解产物有氯气,锰元素化合价降低是氯化锰,反应的化学方程式为:MnCl4═Cl2↑+MnCl2 ,
所以答案是:MnCl4═Cl2↑+MnCl2 ;
③III中无明显现象的原因,可能是c(H+)或c(Cl﹣)较低,将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl﹣) 较低,需要增大到一定浓度才能被MnO2氧化,将 i、ii作对比,加热MnO2和4molL﹣1稀盐酸混合物,加入硫酸和加入氯化钠都生成黄绿色气体,其中氢离子浓度小于氯离子,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl﹣),
所以答案是:III中没有明显现象的原因是c(H+)、c(Cl﹣) 较低,需要增大到一定浓度才能被MnO2氧化;MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl﹣);
④向右管中滴加浓H2SO4至c(H+)≥7molL﹣1,指针偏转幅度变化不大说明氢离子浓度影响不大;再向左管中滴加浓H2SO4至c(H+)≥7molL﹣1,指针向左偏转幅度增大
,说明氢离子浓度对二氧化锰影响大,将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强,
所以答案是:HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强;(2)①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象,无氯气生成,说明盐酸未被浓硫酸氧化,白雾为盐酸小液滴,
所以答案是:不能;
②将湿润的淀粉KI试纸伸入棕黄色气体中试纸先变蓝,后褪色,将湿润的淀粉KI试纸伸入纯净Cl2中试纸先变蓝,后褪色,气体中含氯气、二氧化氮,通过实验 I、II、III证明混合气体中含有Cl2,操作Ⅲ是验证纯净二氧化氮遇到湿润的淀粉KI试纸变化,操作是将湿润的淀粉KI试纸伸入纯净的NO2中,
所以答案是:将湿润的淀粉KI试纸伸入纯净的NO2中;(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl﹣)、c(H+)浓度有关,
所以答案是:c(Cl﹣)、c(H+);

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】探究并回答问题
(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= , V6= , V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
(2)在100℃和200kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
压强(kPa) | 200 | 500 | 1 000 |
B的浓度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡移动(填“正向”“逆向”或“不”),理由是 .
②压强从500kPa增加到1 000kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是 .