题目内容
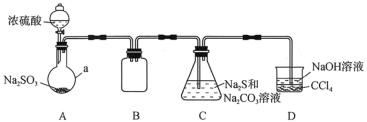
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某研究小组制备硫代硫酸钠晶体(Na2S2O3·5H2O)的实验装置如图所示(省略夹持装置):
(查阅资料)
Ⅰ.Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
Ⅱ.向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3。
根据题意,填写下列空白。
(1)仪器a的名称是___;B的作用是___。
(2)C中反应氧化剂与还原剂的物质的量之比为___。
(3)该实验制取的产品中常含有少量Na2SO3和Na2SO4杂质。为了检验产品中是否含有这两种杂质,某小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的___(填试剂名称),若___(填实验现象),则可以确定产品中含有Na2SO3和Na2SO4。
(4)称取样品137.5g配成500mL溶液。取50mL溶液,向其中加入足量稀硫酸,充分反应(S2O![]() +2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
+2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
准确配制500mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、___、___。经计算,样品中硫代硫酸晶体的百分含量为___。(保留三位有效数字)
【答案】圆底烧瓶 防止倒吸 2:1 稀盐酸 沉淀部分溶解,并有刺激性气味的气体产生 胶头滴管 500mL容量瓶 90.2%
【解析】
根据装置:A装置制备二氧化硫,B装置为安全瓶,C装置由二氧化硫与Na2CO3和Na2S混合液反应制得Na2S2O3,D装置吸收尾气,
(1)根据仪器a的构造可得名称,B为安全瓶;
(2)C中Na2CO3、Na2S和SO2反应制得Na2S2O3,根据化合价分析可得;
(3)根据亚硫酸钡溶解于稀盐酸并且有刺激性气味的气体产生,硫酸钡不溶解于稀盐酸来分析;
(4)配制溶液所需仪器有:天平、药匙、烧杯、玻璃棒、胶头滴管、容量瓶;沉淀1.6g为生成的S,S物质的量为0.05mol,根据反应S2O32-+2H+=S↓+SO2↑+H2O,则有:Na2S2O35H2O~S,则产品中Na2S2O35H2O的物质的量为0.05mol×![]() =0.5mol,据此计算可得。
=0.5mol,据此计算可得。
(1)仪器a为圆底烧瓶;B的作用是安全瓶,防止倒吸;故答案为:圆底烧瓶;防止倒吸;
(2)C中Na2CO3、Na2S和SO2反应制得Na2S2O3,SO2中硫元素化合价降低2价,被还原,为氧化剂,Na2S中硫元素化合价升高4价,被氧化,为还原剂,根据得失电子守恒,故氧化剂与还原剂的物质的量之比为2:1;故答案为:2:1;
(3)根据资料,硫代硫酸钠稀溶液与氯化钡溶液混合无沉淀生成,因为BaSO3难溶于水,可溶于稀盐酸并且有刺激性气味的气体产生,硫酸钡不溶解于稀盐酸,故检验产品中是否含有少量Na2SO3和Na2SO4杂质的方法为:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的稀盐酸,若沉淀部分溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4;故答案为:稀盐酸;沉淀部分溶解,并有刺激性气味的气体产生;
(4)准确配制500mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、胶头滴管、500mL容量瓶;沉淀1.6g为生成的S,S物质的量为0.05mol,根据反应S2O32+2H+=S↓+SO2↑+H2O,则有:Na2S2O35H2OS,则产品中Na2S2O35H2O的物质的量为0.05mol×![]() =0.5mol,故样品中硫代硫酸钠晶体的百分含量为
=0.5mol,故样品中硫代硫酸钠晶体的百分含量为![]() ×100%=90.2%;故答案为:胶头滴管;500mL容量瓶;90.2%。
×100%=90.2%;故答案为:胶头滴管;500mL容量瓶;90.2%。