题目内容
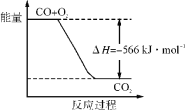
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量来确定有机物组成。
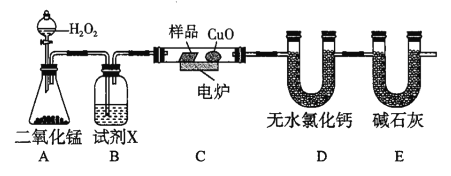
请回答下列问题:
(1)A装置是提供实验所需的O2,写出有关反应的化学方程式__________;B装置中试剂X可选用_________。
(2)若准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),充分反应后,D管质量增加0.36g,E管质量增加0.88g,则该有机物的实验式为________。
(3)要确定该有机物的分子式,还需知道该有机物的_____________,经测定其蒸气密度是相同条件下H2的22倍,则其分子式为___________。
(4)若该有机物的核磁共振氢谱如图所示,则其结构简式为_____________;
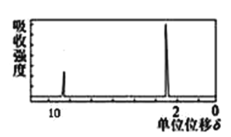
若该有机物只有一种化学环境的氢原子,则其结构简式为___________。
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个E装置,其主要目的是______。
【答案】2H2O2![]() 2H2O+O2↑ 浓硫酸 C2H4O 相对分子质量 C2H4O CH3CHO
2H2O+O2↑ 浓硫酸 C2H4O 相对分子质量 C2H4O CH3CHO ![]() 吸收空气中的CO2和H2O,避免干扰实验
吸收空气中的CO2和H2O,避免干扰实验
【解析】
实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式,因此生成O2后必须除杂(主要是除H2O)。A是生成氧气的装置,B用于干燥通入C中的氧气,可以用浓硫酸,C是在电炉加热时用纯氧气氧化管内样品,D用来吸收生成的水,测定生成水的质量,E用来吸收生成的CO2,测定生成CO2的质.量;根据CO能与CuO反应生成CO2的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2。
(1)A装置为过氧化氢分解制氧气,化学方程式为2H2O2![]() 2H2O+O2↑;根据分析,B中的试剂为浓硫酸;
2H2O+O2↑;根据分析,B中的试剂为浓硫酸;
(2)E管质量增加0.88g为二氧化碳的质量,可得碳元素的质量:0.88g![]() =0.24g,D管质量增加0.36 g是水的质量,可得氢元素的质量:0.36 g
=0.24g,D管质量增加0.36 g是水的质量,可得氢元素的质量:0.36 g![]() =0.04 g,从而可推出含氧元素的质量为0.44 g-0.24 g-0.04 g=0.16 g,则n(C):n(H):n(O)=
=0.04 g,从而可推出含氧元素的质量为0.44 g-0.24 g-0.04 g=0.16 g,则n(C):n(H):n(O)=![]() =2:4:1,即实验式为C2H4O;
=2:4:1,即实验式为C2H4O;
(3)要确定该有机物的分子式,还需知道该有机物的相对分子质量;经测定其蒸气密度是相同条件下H2的22倍,它的相对分子质量为44,故分子式为C2H4O;
(4)根据该有机物的核磁共振氢谱图,有两种氢原子且峰面积之比为1:3,则其结构简式为CH3CHO;若只有一种类型的氢原子,说明结构中含有2个-CH2-,且具有对称性,则该有机物的结构简式为![]() ;
;
(5)再增加一个E装置,防止前一个E装置吸收空气中的二氧化碳和水蒸气,使得二氧化碳的质量产生误差。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
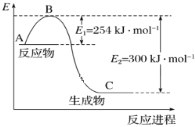
(1)上图是![]() 和
和![]() 反应生成
反应生成![]() 过程中能量的变化示意图,下列有关说法正确的是_______。
过程中能量的变化示意图,下列有关说法正确的是_______。
a. 反应物的总能量比生成物的总能量高
b. 反应物的活化能比生成物的活化能高
c. 反应物的总键能比生成物的总键能高
d. 该反应为熵增反应
(2)请写出![]() 和
和![]() 反应的热化学方程式:_______,决定该反应进行方向的主要判据为________。
反应的热化学方程式:_______,决定该反应进行方向的主要判据为________。
(3)试根据表中及图中数据计算![]() 的键能______________ kJ/mol;
的键能______________ kJ/mol;
化学键 |
|
|
键能/ kJ/mol | 390 | 943 |
(4)用![]() 催化还原
催化还原![]() 还可以消除氮氧化物的污染。已知:
还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
若1molNH3还原NO至N2,则该反应过程中的反应热△H3=_____________kJ/mol(用含a、b的式子表示)。
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
【题目】【化学—选修3:物质结构与性质】第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn原子价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________区。Ti的一种氧化物X,其晶胞结构如上图所示,则X的 化学式为 。

(4)某铁的化合物结构简式如右图所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为
(用元素符号表示)
②在右图中用“→”标出亚铁离子的配位键。

(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为 ,这几个O2-构成的空间构型为 。已知Ni2+与O2-的核间距为anm, NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。