题目内容
12.对下列化学用语描述和理解都正确的是( )| A. | 原子结构示意图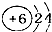 ,可以表示12C,也表示14C ,可以表示12C,也表示14C | |
| B. | 比例模型 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 | |
| C. | 结构示意图为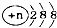 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
分析 A.同位素的质子数、核外电子数相同,中子数不同;
B.二氧化碳是直线型分子,水分子是V型分子;
C.如果n=16,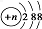 为硫离子,硫离子能够破坏水的电离平衡;
为硫离子,硫离子能够破坏水的电离平衡;
D.氢氧根离子带一个单位的负电荷.
解答 解:A.同位素的质子数和核外电子数相同,所以其原子结构示意图相同,故A正确;
B.二氧化碳是直线型分子,水分子在V型分子,该比例模型是水分子模型,故B错误;
C.结构示意图为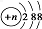 的阴离子中,当n=16时,表示的为硫离子,硫化氢为弱酸,故硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
的阴离子中,当n=16时,表示的为硫离子,硫化氢为弱酸,故硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
D.氢氧根离子的电子式为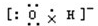 ,羟基的电子式为
,羟基的电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式、比例模型、原子结构示意图等知识,题目难度中等,注意掌握常见的化学用语的概念及正确的表示方法,明确羟基与氢氧根离子的区别.

练习册系列答案
相关题目
3.X、Y、Z为短周期元素,X的单质与水在常温条件下就能剧烈反应生成一种还原性气体,Y的最高价氧化物对应的水化物是一种酸性最强的酸;Z与Y同周期且只能形成ZY3;X、Z的简单离子核外电子排布相同.下列有关叙述正确的是( )
| A. | 离子半径:X>Y>Z | B. | 最外层电子数:Y>Z>X | ||
| C. | 原子序数:Z>Y>X | D. | 单质熔点:X>Z>Y |
20.逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是( )
| A. | 有机物一定含有碳元素,所以含碳元素的化合物一定是有机物 | |
| B. | 置换反应中有单质生成,所以有单质生成的反应一定属于置换反应 | |
| C. | 含碳元素的物质在O2中充分燃烧会生成CO2,所以在O2中燃烧能生成CO2的物质一定含碳元素 | |
| D. | 盐的组成中含有金属阳离子与酸根离子,所以盐中一定不含氢元素 |
17.如图是草酸溶液中H2C2O4、HC2O4-三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量被度和的比值)与pH的关系图,下到有关说法不正确的是( )
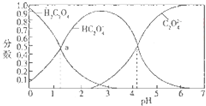

| A. | pH=5的溶液中c(C2O42-)>c(HC2O4-) | |
| B. | NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| C. | 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中2c(Na+)=c(HC2O4-)+c(H2C2O4) | |
| D. | 为使溶液中c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右 |
4.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | X和Y两元素一定不在同一周期 | |
| C. | 元素Z、W的简单离子的电子层结构相同 | |
| D. | X、W两元素一定能形成两种组成不同的氧化物 |
2.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨).下列说法不正确的是( )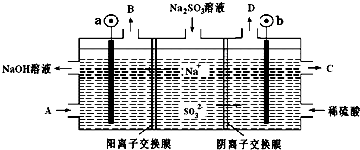

| A. | b电极上的主反应是 SO32--2e-+H2O═SO42-+2H+ | |
| B. | 若D是混合气体,则可能含有SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 | |
| D. | A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
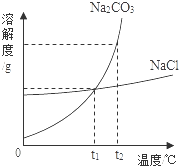 我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题:
我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题: