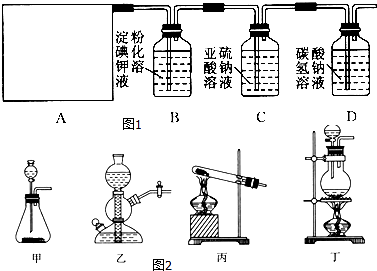
题目内容
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如下:
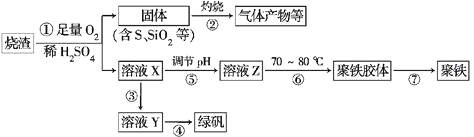
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
如何检验溶液Y中存在Fe2+?__________________________________________
(4)在实验室里,完成过程④的操作是____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的陶瓷仪器有___________________________。
(5)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
【答案】 acd 4FeS+3O2+12H+=4Fe3++6H2O+4S Fe(或铁) Fe2(SO4)3+Fe=3FeSO4 取少量溶液置于洁净试管中,滴加琉氰化钾溶液,无明显现象,再滴加双氧水(或新制氯水),溶液变为血红色,说明溶液中存在Fe2+ 蒸发浓缩,冷却结晶 蒸发皿、玻璃棒 31.1 %
【解析】(1)固体中含有S、SiO2,将其灼烧。其中的S会变为SO2气体,SO2气体有漂白性,能使品红溶液褪色,SO2气体有还原性,能使酸性KMnO4溶液或溴水因发生氧化反应而褪色,但是使紫色石蕊试液变为红色。因此答案选acd;(2)过程①中,根据框图中的各种物质及质量守恒定律和电子守恒、电荷守恒可知:FeS和O2、H2SO4反应的离子方程式为4FeS+3O2+12H+=4Fe3++6H2O+4S;(3)由于发生反应得到的物质中含有Fe3+.,而最后要制取绿矾FeSO4,所以过程③中,要加入还原剂Fe粉,发生反应的化学方程式为:Fe2(SO4)3+Fe=3FeSO4;检验溶液Y中存在Fe2+的方法为:取少量溶液置于洁净试管中,滴加琉氰化钾溶液,无明显现象,再滴加双氧水(或新制氯水),溶液变为血红色,说明溶液中存在Fe2+;(4)在实验室里,完成过程④由溶液得到绿矾,其操作是蒸发浓缩、冷却结晶,需要使用酒精灯、三脚架、坩埚钳等,还需要的陶瓷仪器有,还需要的仪器有蒸发皿、玻璃棒;(5)n(SO42-)=![]() =0.015mol,n(Fe)= n(SO42-)= 0.015mol,所以m(Fe)=0.015mol×56g/mol=0.84g,所以该聚铁样品中铁元素的质量分数为
=0.015mol,n(Fe)= n(SO42-)= 0.015mol,所以m(Fe)=0.015mol×56g/mol=0.84g,所以该聚铁样品中铁元素的质量分数为 ![]() ×100%=31.1%。
×100%=31.1%。