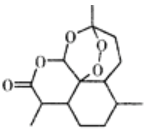
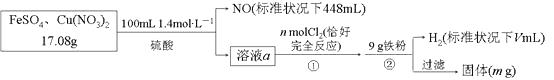
题目内容
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g).2min后该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,下列判断错误的是( )
A.x=1
B.2 min内A的反应速率为0.3 mol/(Lmin)
C.B的转化率为40%
D.若混合气体的密度不变,则表明该反应达到平衡状态
【答案】D
【解析】解:A.平衡时生成的C的物质的量为0.2molL﹣1×2L=0.4mol,物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,故A正确;B.2min内生成0.8mol D,故2 min内D的反应速率v(D)= ![]() =0.2 mol(Lmin)﹣1 , 速率之比等于化学计量数之比,故v(A)=
=0.2 mol(Lmin)﹣1 , 速率之比等于化学计量数之比,故v(A)= ![]() v(D)=
v(D)= ![]() ×0.2 mol(Lmin)﹣1=0.3 mol(Lmin)﹣1 , 故B正确;
×0.2 mol(Lmin)﹣1=0.3 mol(Lmin)﹣1 , 故B正确;
C.2min末该反应达到平衡,生成0.8mol D,由方程式3A(g)+B(g)xC(g)+2D(g)可知,参加反应的B的物质的量为:0.8mol× ![]() =0.4mol,故B的转化率为
=0.4mol,故B的转化率为 ![]() =100%=40%,故C正确;
=100%=40%,故C正确;
D.容器的容积不变,混合气体的质量不变,密度为定值,始终不变,故混合气体的密度不变,不能说明反应达到平衡状态,故D错误;
故选D.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.△H>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO,CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率
【题目】(多选)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是( )
组别 | c(HCl)(mol/L) | 温度(℃) | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 块状 |
4 | 2.5 | 30 | 粉末状 |
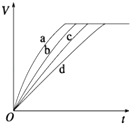
A.4﹣3﹣2﹣1
B.1﹣2﹣3﹣4
C.3﹣4﹣2﹣1
D.1﹣2﹣4﹣3