题目内容
6.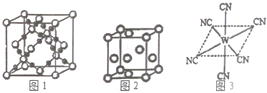 已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:
已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:(1)BA2C分子中B原子的杂化方式为sp2杂化,BA2C分子的空间构型为平面三角形.
(2)写出与BC2分子互为等电子体的一种分子的化学式N2O或CS2.BC2在高温高压下所形成晶体的晶胞如右图l所示.则该晶体的类型属于原子晶体(选填“分子”、“原子”、“离子”或“金属”);
(3)经光谱测定证实单质D与强碱溶液反应有[D(OH)4]-生成,则[D(OH)4]-中存在abc.
a.共价键 b.配位键 c.σ键 d.π键
(4)“生物金属”E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如右图2所示.则晶胞中E原子的配位数为12;若该晶胞的密度为p g.cm-3,阿伏加德罗常数为NA,E原子的摩尔质量为Mrg.mol-1,则该晶胞的棱长为$\root{3}{\frac{4Mr}{p{N}_{A}}}$ cm.
(5)W元素应用非常广泛,如果人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图3所示.
①W元素基态原子价电子排布式为3d64s2.
②写出W (CN)2溶于过量KCN溶液的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
分析 A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍,只能是A处于第一周期、D处于第三周期,则A为H元素,D为Al;B原子核外电子有6种不同的运动状态,则B为碳元素;C原子L层上有2对成对电子,核外电子排布为1s22s22p4,故C为O元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,原子核外电子数为18+4=22,则E为Ti;W位于周期表中第8列,则W为Fe,据此解答.
解答 解:A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍,只能是A处于第一周期、D处于第三周期,则A为H元素,D为Al;B原子核外电子有6种不同的运动状态,则B为碳元素;C原子L层上有2对成对电子,核外电子排布为1s22s22p4,故C为O元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,原子核外电子数为18+4=22,则E为Ti;W位于周期表中第8列,则W为Fe,
(1)CH2O分子为甲醛,分子中C原子形成3个σ键、没有孤电子对,故C原子采取sp2杂化,杂化轨道全部用于成键,为平面三角形结构,
故答案为:sp2杂化;平面三角形;
(2)与CO2分子互为等电子体的一种分子为N2O或CS2,CO2在高温高压下所形成晶体,由其晶胞结构可知晶胞中白色球数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,黑色球数目为16,故白色球为C元素、黑色球为O原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,
故答案为:N2O或CS2;原子;
(3)[Al(OH)4]-中铝离子与氢氧根离子之间存在配位键、氢氧根离子中氧原子与氢原子之间形成共价键,属于σ键,离子中没有π键,
故选:abc;
(4)“生物金属”Ti内部原子的堆积方式是面心立方堆积,以顶点原子研究,与之相邻的原子位于面心,每个顶点原子为12面共用,故则晶胞中E原子的配位数为12;
晶胞中Ti原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{Mr}{{N}_{A}}$g,若该晶胞的密度为p g.cm-3,则晶胞棱长=$\root{3}{\frac{4×\frac{Mr}{{N}_{A}}g}{pg/c{m}^{3}}}$=$\root{3}{\frac{4Mr}{p{N}_{A}}}$cm,
故答案为:12;$\root{3}{\frac{4Mr}{p{N}_{A}}}$;
(5)W元素应用非常广泛,如果人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图3所示.
①W为Fe元素,核外电子数为26,基态原子价电子排布式为3d64s2,
故答案为:3d64s2;
②Fe(CN)2溶于过量KCN溶液生成[Fe(CN)6]4-配离子,化学方程式为:Fe(CN)2+4KCN=K4[Fe(CN)6],
故答案为:Fe(CN)2+4KCN=K4[Fe(CN)6].
点评 本题是对物质结构的考查,涉及杂化轨道、分子构型、等电子体、晶胞结构与计算、化学键等,需要学生具备扎实的基础与迁移运用能力,难度中等.

| A. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | B. | 3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | ||
| C. | 2Mg+CO2═C+2MgO | D. | CO+H2O(g)═CO2+H2 |
| A. | 2014年诺贝尔化学奖授予发明超分辨屏荧光显微镜的科学家,他们使光学显微镜分屏率提高到纳米尺度.利用超分辨率荧光显微镜可以观察到胶体中的胶粒 | |
| B. | 人体从食物中摄取蛋白质,在体内先水解成各种氨基酸,经过不断的分解,最终生成水和二氧化碳排除体外 | |
| C. | 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 我国油品从国四汽油升级到国v汽油,有助于减少酸雨、雾霾,提高空气质量 |
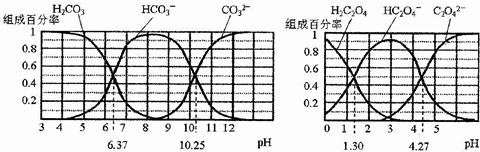
| A. | 在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
| A. | 3种 | B. | 6种 | C. | 12种 | D. | 18种 |

| A. | 上述过程中,NOX只被CO还原 | |
| B. | 安装该净化器的汽车使用含铅汽油不会造成污染 | |
| C. | 产生22.4L氮气(标准状况)时,转移4xmole- | |
| D. | Pt-Rh催化剂可提高尾气平衡转化率 |
| A. | 玻璃破碎 | B. | 冰雪融化 | C. | 食物腐败 | D. | 衣服晾干 |
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| C. | 加快开发高效洁净能源转换技术,缓解能源危机 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 |
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| D. | 0.1mol/L的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |