题目内容
14.H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示:下列说法正确的是( )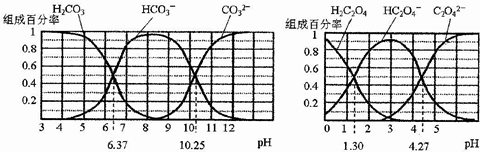
| A. | 在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
分析 A、据图分析在pH为6.37时溶液中无碳酸根离子,pH=10.25时,溶液中无碳酸分子;
B、反应HCO3-+H2O?H2CO3+OH-的平衡常数为K=$\frac{[{H}_{2}C{O}_{3}]•[O{H}^{-}]}{[HC{{O}_{3}}^{-}]}$,据pH=6.37时计算;
C、据物料守恒分析;
D、草酸的酸性比醋酸强,往Na2CO3溶液中加入少量草酸溶液,能够生成碳酸氢根离子.
解答 解:A、在pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),故A错误;
B、反应HCO3-+H2O?H2CO3+OH-的平衡常数为K=$\frac{[{H}_{2}C{O}_{3}]•[O{H}^{-}]}{[HC{{O}_{3}}^{-}]}$,pH=6.37时,c(H2CO3)=c(HCO3-),K=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6.37}}$=10-7.63,根B错误;
C、在0.1mol•L-1NaHC2O4溶液中有c(C2O42-)、c(HC2O4-)和c(H2C2O4),据物料守恒c(C2O42-)+c(HC2O4-)+c(H2C2O4)=c(Na+)=0.1mol•L-1,故C错误;
D、草酸的酸性比碳酸强,往Na2CO3溶液中加入少量草酸溶液,能够生成碳酸氢根离子,发生反应:CO32-+H2C2O4=HCO3-+HC2O4-,故D正确;
故选D.
点评 本题考查了据图分析不同pH时溶液中离子的存在形式,注意利用电荷守恒和物料守恒分析,题目难度不大.

练习册系列答案
相关题目
3.在水溶液中能够大量共存的是( )
| A. | Na+、C1-、NO3-、Ba2+ | B. | Ag+、C1-、NO3-、Ca2+ | ||
| C. | NH4+、OH-、SO42-、Cu2+ | D. | Na+、Fe2+、OH-、H+ |
9.下列说法正确的是( )
| A. | 绿色化学是指利用化学原理对已产生的环境污染进行治理 | |
| B. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 今年,来自德国、加拿大和我国复旦、清华大学的研究人员通过紧密合作,成功制备出了含+9铱元素的离子(${IrO}_{n}^{+}$),在这种离子中n=8 | |
| D. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用STM技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 |
19.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI.L-l浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 28gN2与28g C18O中含有的质子数均为14 |
3.下列实验装置设计合理,且能达到相应实验目的是:( )
| 选项 | 实验装置 | 实验目的 |
| A | 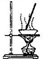 | 加热硫酸铜晶体获得无水硫酸铜 |
| B | 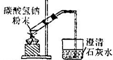 | 加热碳酸氢钠,证明它能分解释放出二氧化碳气体 |
| C | 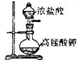 | 实验室制取氯气 |
| D | 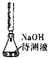 | 用中和滴定的方法测定某氢氧化钠待测液的浓度 |
| A. | A | B. | B | C. | C | D. | D |
4.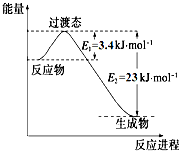 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=0.17.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组[ | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:
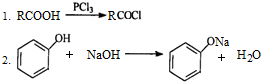
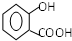 .
.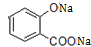 .
.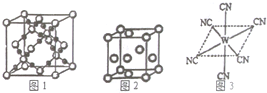 已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:
已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答: