题目内容
13.(1)指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数:Cu2+、CN-、4.(2)在[Fe(CN)6]3-中,中心原子的配位数为6,配体的立体构型是直线形.
(3)配合物[Cr(H2O)4Br2]Br•2H2O中,中心原子的化合价为+3,内界的电荷数为+1.
分析 (1)根据配合物K2[Cu(CN)4]结构分析中心离子为Cu2+、配体为CN-、配位数为4;
(2)根据配合物离子[Fe(CN)6]3-结构分析配体为CN-、配位数为6;
(3)根据化合物中各元素化合价的代数和为0计算中心离子的化合价及配离子所带电荷.
解答 解:(1)根据配合物K2[Cu(CN)4]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Cu2+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为4,故答案为:Cu2+、CN-、4;
(2)根据配合物离子[Fe(CN)6]3-结构分析,有孤对电子的原子或离子为配体,所以配体为CN-,只有2个原子所以立体构型是直线形,配位数就是配体的个数,所以配位数为6,故答案为:6;直线形;
(3)[Cr(H2O)4Br2]Br•2H2O中,溴带一个单位负电荷,所以配离子带1个单位的正电荷,[Cr(H2O)4Br2]Br•2H2O中阴离子是溴离子,溴离子的化合价是-1价,所以铬离子的化合价是+3价,故答案为:+3;+1.
点评 本题考查了配合物的配位体的判断、配位数的计算方法、成键情况、化合物中元素的化合价代数和为0等知识,注意配位数个数的计算方法、中心原子的杂化方式等,为易错点,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
3.下列事实与氢键有关的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 | |
| D. | 氨气在水中溶解度很大 |
8.雷雨天闪电时空气中有臭氧生成.下列说法正确的是( )
| A. | O2与O3互为同位素 | |
| B. | O2与O3的相互转化是物理变化 | |
| C. | 在相同的温度与压强下,等体积的O2与O3含有相同的分子数 | |
| D. | 等物质的量的O2与O3含有相同的质子数 |
18.下列说法正确的是( )
| A. | 有些物质是由分子直接构成的,化学式能准确表示该物质分子组成,如白磷(P4)、二氧化碳(CO2)、氯化铵(NH4Cl)等 | |
| B. | C2H2与BeCl2分子中的中心原子杂化轨道的类型相同 | |
| C. | 在1molSiO2晶体中,含有2molSi-O键 | |
| D. | NC13分子中N-C1键键长比CCl4分子中C-C1键键长长 |
2. 25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
 25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | 根据曲线可得Ka(HF)=0.01 | |
| B. | 当pH=3时,c(Na+)>c(F-) | |
| C. | 当pH=3.45时,2c(Na+)=c(F-)+c(HF) | |
| D. | 当pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol•L-1 |
 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.
 ;
; .
. 现有如下两个反应:
现有如下两个反应: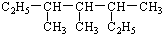 3,4,5-三甲基庚烷
3,4,5-三甲基庚烷

 B.
B.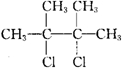 C.
C. .
.