题目内容
1. 现有如下两个反应:
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Fe=3FeCl2
(1)根据两反应本质,分别判断能否用于设计原电池(A)不行、(B)行.
(2)如果不能,说明其原因(A)不是氧化还原反应,没有发生电子的转移.
(3)如果可以,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式.
Cu或C是正极,正极反应式:2Fe3++2e-=2Fe2+;
Fe是负极,负极反应式:Fe-2e-=Fe2+.
分析 (1)原电池反应是自发进行的放热的氧化还原反应;
(2)原电池反应是自发进行的放热的氧化还原反应;
(3)该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反.
解答 解:(1)原电池反应是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,不属于氧化还原反应,所以不能设计成原电池,(B)中Fe元素化合价发生变化,所以可以设计成原电池,故答案为:(A)不行(B)可以;
(2)(A)不是氧化还原反应,没有发生电子的转移,所以不能设计成原电池,故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反,Fe是负极、Cu是正极,电子从Fe沿导线流向Cu,电流从Cu沿导线流向Fe,实验装置图如右图所示: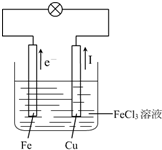
正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;
负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,
故答案为:Cu(或C);2Fe3++2e-=2Fe2+;Fe;Fe-2e-=Fe2+.
点评 本题考查原电池设计,侧重考查学生知识运用能力及实验方案设计能力,明确原电池原理是解本题关键,会根据电池反应式确定正负极及电解质溶液,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
12.物质组成为C3H6O2的有机物,能与锌反应,由此可知不与它发生反应的物质是( )
| A. | 氢氧化钠溶液 | B. | 溴乙烷 | C. | 甲醇 | D. | 苯酚钠 |
9.下列说法中不正确的是( )
| A. | 原电池中电子流出的一极为正极,发生氧化反应 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池中阴离子向负极移动 | |
| D. | 原电池正极上发生还原反应 |
10.煤和石油与生活密切相关,下列有关煤和石油的综合利用中,属于物理变化的是( )
| A. | 煤的干馏 | B. | 煤的气化和液化 | ||
| C. | 石油的分馏 | D. | 石油的裂化和裂解 |
6.由于发生化学反应而使溴水褪色的一组物质是( )
①甲苯 ②聚乙烯 ③四氯化碳 ④2-丁炔 ⑤(CH3)2C=CHCH3.
①甲苯 ②聚乙烯 ③四氯化碳 ④2-丁炔 ⑤(CH3)2C=CHCH3.
| A. | ①④ | B. | ②④⑤ | C. | ④⑤ | D. | ①③④⑤ |

