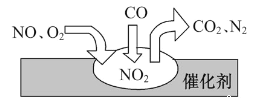
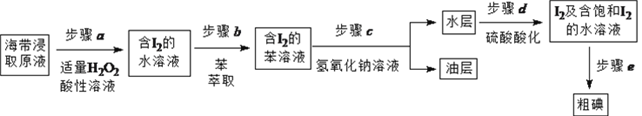题目内容
【题目】Ⅰ、在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:
(1)该温度下水的离子积常数KW=________。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L。
(3)在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=________。
Ⅱ、现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(4)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)___________。
(5)④、⑤、⑦、⑧四种溶液中NH![]() 浓度由大到小的顺序是 (填序号)_________________。
浓度由大到小的顺序是 (填序号)_________________。
(6)将③和④等体积混合后,混合液中各离子浓度关系正确的是________(填字母序号)。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH![]() )
)
B.c(Na+)=0.1 mol/L
C.c(Na+)+c(NH![]() )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
Ⅲ、常温下,amol/L氯化铵溶液中加入等体积bmol/L氢氧化钠溶液,反应后混合液呈中性,求该温度下NH3·H2O的电离常数________。
【答案】 10-12 mol2·L-2 10-b-10-a 11 ④>②>③>① ⑦>④>⑤>⑧ A (a-b)10-7/b
【解析】试题分析:Ⅰ、(1)水的离子积常数KW=![]() ;(2)c(NaOH)= c(Na+),根据电荷守恒c(Na+)+ c(H+)= c(OH-)计算c(Na+);(3)将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,氢氧化钠有剩余,根据
;(2)c(NaOH)= c(Na+),根据电荷守恒c(Na+)+ c(H+)= c(OH-)计算c(Na+);(3)将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,氢氧化钠有剩余,根据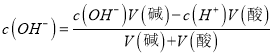 计算c(OH-),根据KW计算c(H+),最后计算PH;Ⅱ、(4)向水中加入酸或碱均能抑制H2O的电离,且酸或碱电离出的H+或OH-浓度越大,由水电离出的H+浓度越小;盐的水解能促进水的电离; (5)④氯化铵、⑤醋酸铵、⑦硫酸氢铵等溶液中存在:NH4++H2O
计算c(OH-),根据KW计算c(H+),最后计算PH;Ⅱ、(4)向水中加入酸或碱均能抑制H2O的电离,且酸或碱电离出的H+或OH-浓度越大,由水电离出的H+浓度越小;盐的水解能促进水的电离; (5)④氯化铵、⑤醋酸铵、⑦硫酸氢铵等溶液中存在:NH4++H2O![]() NH3H2O+H+,其中硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑧氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小;(6) ③和④等体积混合后,溶质为NaCl和NH4Cl,由于溶液中存在:NH3H2O
NH3H2O+H+,其中硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑧氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小;(6) ③和④等体积混合后,溶质为NaCl和NH4Cl,由于溶液中存在:NH3H2O![]() NH4++OH-,则c(Na+)=c(CI-)>c(NH4+),c(OH-)>c(H+),又溶液中存在水的电离,则c(OH-)>c(NH4+)。Ⅲ、常温下,amol/L氯化铵溶液中加入等体积bmol/L氢氧化钠溶液,反应后混合液呈中性c(OH-)=c(H+),根据电荷守恒c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ c(CI-),则c(Na+)+ c(NH4+)= c(CI-),根据物料守恒c(Na+)=
NH4++OH-,则c(Na+)=c(CI-)>c(NH4+),c(OH-)>c(H+),又溶液中存在水的电离,则c(OH-)>c(NH4+)。Ⅲ、常温下,amol/L氯化铵溶液中加入等体积bmol/L氢氧化钠溶液,反应后混合液呈中性c(OH-)=c(H+),根据电荷守恒c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ c(CI-),则c(Na+)+ c(NH4+)= c(CI-),根据物料守恒c(Na+)=![]() mol/L 、c(CI-)=
mol/L 、c(CI-)=![]() mol/L 、c(NH4+)+c(NH3H2O)=
mol/L 、c(NH4+)+c(NH3H2O)= ![]() mol/L ,根据
mol/L ,根据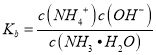 计算NH3·H2O的电离常数;
计算NH3·H2O的电离常数;
解析:Ⅰ、(1)水的离子积常数KW=![]() mol2·L-2;(2)c(NaOH)= c(Na+),根据电荷守恒c(Na+)+ c(H+)= c(OH-),c(Na+)= c(OH-)- c(H+)=10-b-10-a,所以该NaOH溶液的物质的量浓度的精确值是10-b-10-a mol/L;(3)将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,氢氧化钠有剩余,根据
mol2·L-2;(2)c(NaOH)= c(Na+),根据电荷守恒c(Na+)+ c(H+)= c(OH-),c(Na+)= c(OH-)- c(H+)=10-b-10-a,所以该NaOH溶液的物质的量浓度的精确值是10-b-10-a mol/L;(3)将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,氢氧化钠有剩余,根据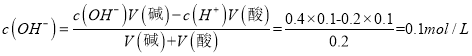 , c(H+)=
, c(H+)= 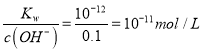 , PH=11;Ⅱ、向水中加入酸或碱均能抑制H2O的电离,且酸或碱电离出的H+或OH-浓度越大,由水电离出的H+浓度越小;盐的水解能促进水的电离;①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,②醋酸为弱酸,溶液中c(H+)较小,对水电离的抑制作用小,④氯化铵为强酸弱碱盐,水解促进水的电离,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①;(5)④氯化铵、⑤醋酸铵、⑦硫酸氢铵等溶液中存在:NH4++H2O
, PH=11;Ⅱ、向水中加入酸或碱均能抑制H2O的电离,且酸或碱电离出的H+或OH-浓度越大,由水电离出的H+浓度越小;盐的水解能促进水的电离;①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,②醋酸为弱酸,溶液中c(H+)较小,对水电离的抑制作用小,④氯化铵为强酸弱碱盐,水解促进水的电离,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①;(5)④氯化铵、⑤醋酸铵、⑦硫酸氢铵等溶液中存在:NH4++H2O![]() NH3H2O+H+,其中硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑧氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小,所以NH
NH3H2O+H+,其中硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑧氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小,所以NH![]() 浓度由大到小的顺序是⑦>④>⑤>⑧;(6) ③和④等体积混合后,溶质为NaCl和NH4Cl,由于溶液中存在:NH3H2O
浓度由大到小的顺序是⑦>④>⑤>⑧;(6) ③和④等体积混合后,溶质为NaCl和NH4Cl,由于溶液中存在:NH3H2O![]() NH4++OH-,则c(Na+)=c(CI-)>c(NH4+),c(OH-)>c(H+),又溶液中存在水的电离,则c(OH-)>c(NH4+),,根据分析A.c(Na+)=c(Cl-)>c(OH-)>c(NH
NH4++OH-,则c(Na+)=c(CI-)>c(NH4+),c(OH-)>c(H+),又溶液中存在水的电离,则c(OH-)>c(NH4+),,根据分析A.c(Na+)=c(Cl-)>c(OH-)>c(NH![]() ),故A正确; B.根据物料守恒c(Na+)=0.05 mol/L,故B错误; C.根据电荷守恒c(Na+)+c(NH
),故A正确; B.根据物料守恒c(Na+)=0.05 mol/L,故B错误; C.根据电荷守恒c(Na+)+c(NH![]() )+ c(H+)=c(Cl-)+c(OH-),故C错误; D.溶液呈碱性c(H+)<c(OH-),故D错误。Ⅲ、常温下,amol/L氯化铵溶液中加入等体积bmol/L氢氧化钠溶液,反应后混合液呈中性c(OH-)=c(H+),根据电荷守恒c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ c(CI-),则c(Na+)+ c(NH4+)= c(CI-),根据物料守恒c(Na+)=
)+ c(H+)=c(Cl-)+c(OH-),故C错误; D.溶液呈碱性c(H+)<c(OH-),故D错误。Ⅲ、常温下,amol/L氯化铵溶液中加入等体积bmol/L氢氧化钠溶液,反应后混合液呈中性c(OH-)=c(H+),根据电荷守恒c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ c(CI-),则c(Na+)+ c(NH4+)= c(CI-),根据物料守恒c(Na+)=![]() mol/L 、c(CI-)=
mol/L 、c(CI-)=![]() mol/L 、c(NH4+)+c(NH3H2O)=
mol/L 、c(NH4+)+c(NH3H2O)= ![]() mol/L,
mol/L, 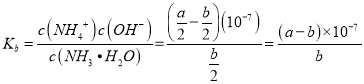 。
。

【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在潮湿空气中易水解氧化;见光则分解,变成褐色;CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)
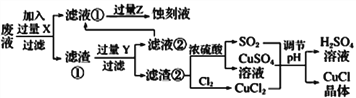
根据以上信息回答下列问题:
(1)写出生产过程中所用物质的名称:____________,________________。
(2)写出产生CuCl的化学方程式:________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由________________________________________________。实际生产中SO2要适当过量,原因可能是___(答一点即可).
(4)得到CuC1晶体后,还需要经过水洗、乙醇洗涤两步操作。用乙醇洗涤的作用是________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为_________,当pH较大时CuCl产率变低原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10molL-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 | /tr>
则样品中CuCl的纯度为_______________(结果保留三位有效数字)。
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀