题目内容
【题目】煤炭燃烧产生的SO2、CO、NO2等造成了严重的大气污染问题。
(1) CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H=-234 kJ·mol-1
③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =________ kJ·mol-1
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤在相同条件下,燃烧时向环境释放出的热量会减少______ kJ。
(2)利用CO和H2在催化剂作用下合成甲醇,是减少污染的一种新举措,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
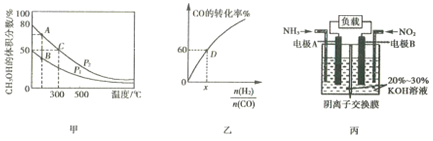
①上述合成甲醇的反应是______(填“吸热”或“放热”)反应,判断的理由是_____。
②图甲中A、B、C三点中反应速率最大的是______(填写“A”、“ B” 或“ C”)。
③在300℃时,向C点平衡体系中再充入0.25molCO,0.5molH2和0.25molCH3OH,该平衡______(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
(4)利用原电池原理可将NO2和NH3转化为无污染物质,其装置原理图如图丙所示,则负极反应式为______________。
【答案】 -1038 356 放热 升高温度,CH3OH的体积分数减小,平衡逆向移动,正反应放热 C 向正反应方向 3 2NH3-6e-+6OH-=N2+6H2O
【解析】分析:(1) 根据盖斯定律将①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1,②2CaSO2(s)+O2(g)=2CaSO3(s)△H=-234 kJ·mol-1按照①×2+②处理即可;燃烧时向环境释放出的热量会减少的热量为碳酸钙分解吸收的热量;
(2)①根据图像甲,升高温度,CH3OH的体积分数逐渐减小,说明平衡逆向移动;②首先根据图像甲分析判断出P2>P1,温度越高,压强越大,反应速率越快;③首先计算判断平衡时C点的组成,在分析恒容容器中再充入0.25molCO,0.5molH2和0.25molCH3OH,对平衡的影响;
(3) 根据图像乙,D点CO的转化率为60%,结合D点氢气的转化率计算判断x的值;
(4) NO2和NH3转化为无污染物质为氮气和水,负极上氨气发生氧化反应。
详解:(1) ①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1,②2CaSO2(s)+O2(g)=2CaSO3(s) △H=-234 kJ·mol-1,③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1,根据盖斯定律,将①×2+②得:2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =(-402 kJ·mol-1)×2+(-234 kJ·mol-1)= -1038kJ·mol-1;向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤,根据方程式,固定2molSO2,放出1038kJ的热量,同时需要分解2mol CaCO3,需要吸热356 kJ,因此在相同条件下,燃烧时向环境释放出的热量会减少356 kJ,故答案为:-1038;356;
(2)①根据图像,升高温度,CH3OH的体积分数逐渐减小,说明平衡逆向移动,合成甲醇的反应是放热反应,故答案为:放热;升高温度,CH3OH的体积分数减小,平衡逆向移动,正反应放热;
②CO(g)+2H2(g) ![]() CH3OH(g)是气体的物质的量减小的反应,压强越大,平衡时CH3OH的体积分数越大,则P2>P1,温度越高,压强越大,反应速率越快,图甲中A、B、C三点中反应速率最大的是C,故答案为:C;
CH3OH(g)是气体的物质的量减小的反应,压强越大,平衡时CH3OH的体积分数越大,则P2>P1,温度越高,压强越大,反应速率越快,图甲中A、B、C三点中反应速率最大的是C,故答案为:C;
③C点 CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 2 0
反应(mol) x 2x x
平衡(mol)1-x 2-2x x
则![]() ×100%=50%,解得:x=0.75mol,因此平衡时有0.25molCO,0.5molH2和0.75molCH3OH,恒容容器中再充入0.25molCO,0.5molH2和0.25molCH3OH,可以看成先充入
×100%=50%,解得:x=0.75mol,因此平衡时有0.25molCO,0.5molH2和0.75molCH3OH,恒容容器中再充入0.25molCO,0.5molH2和0.25molCH3OH,可以看成先充入![]() molCO,
molCO,![]() molH2和0.25molCH3OH,相当于增大压强,再充入
molH2和0.25molCH3OH,相当于增大压强,再充入![]() molCO,
molCO,![]() molH2,平衡均正向移动,故答案为:向正反应方向;
molH2,平衡均正向移动,故答案为:向正反应方向;
(3) D点CO的转化率为60%,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 x 0
反应(mol) 0.6 1.2 0.6
平衡(mol)0.4 x-1.2 0.6
D点氢气的转化率为40%=![]() ,x=3,故答案为:3;
,x=3,故答案为:3;
(4)利用原电池原理可将NO2和NH3转化为无污染物质氮气和水,负极上氨气发生氧化反应,反应式为2NH3-6e-+6OH-=N2+6H2Ospan>,故答案为:2NH3-6e-+6OH-=N2+6H2O。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案