题目内容
9.下列各种比较中,正确的是( )| A. | 元素电负性:Ti<Ga | |
| B. | 第二电离能(I2):Na>Mg | |
| C. | 金属晶体的晶胞中空间利用率:体心立方堆积>面心立方堆积. | |
| D. | 晶格能:NaCl>MgO |
分析 A.金属性强,电负性小;
B.Na失去1个电子为稳定结构,而Mg失去1个电子没有达到稳定结构;
C.体心立方堆积为68%,六方最密堆积为74%,面心立方最密堆积为74%;
D.电荷越大,离子半径越小,则晶格能越大.
解答 解:A.金属性强,电负性小,则元素电负性为Ti>Ga,Ge具有一定的非金属性,故A错误;
B.Na失去1个电子为稳定结构,而Mg失去1个电子没有达到稳定结构,Na难失去2个电子,则第二电离能(I2):Na>Mg,故B正确;
C.体心立方堆积为68%,六方最密堆积为74%,面心立方最密堆积为74%,则金属晶体的晶胞中空间利用率:体心立方堆积<面心立方堆积,故C错误;
D.电荷越大,离子半径越小,则晶格能越大,则晶格能为NaCl<MgO,故D错误;
故选B.
点评 本题考查物质结构与性质,为选修三中高频考点,把握电负性、第二电离能、晶格能的比较方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
19.下列事实中能说明醋酸是弱电解质的是( )
| A. | 用醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1 mol?L-1醋酸溶液的c(H+)约为0.004 mol•L-1 |
20.1L 0.3mol/L的NaOH溶液中,缓慢通入标准状况的CO2气体4.48L,待完全反应后,下列关系式正确的是( )
| A. | C(Na+)=C(CO32-)+C(HCO3-)+C(OH-) | |
| B. | C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-) | |
| C. | C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-) | |
| D. | C(CO32-)+2C(OH-)=3C(H2CO3)+C(HCO3-)+2C(H+) |
4.下列说法中正确的是( )
| A. | 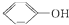 与 与 互为同系物 互为同系物 | B. | 乙醇和乙醚互为同分异构体 | ||
| C. | 可用溴水来区分苯和苯的同系物 | D. | 乙醇、乙二醇、丙三醇互为同系物 |
14.下列各分子中所有原子都满足最外层为8电子稳定结构的化合物是( )
| A. | BeCl2 | B. | PCl3 | C. | PCl5 | D. | N2 |
1.某粒子用符号AZMn+表示,下列关于该粒子的叙述中,正确的是( )
| A. | 所含质子数为(A-n) | B. | 所含中子数为(A-Z) | ||
| C. | 所含电子数为(Z+n) | D. | 中子数-电子数=A-2Z-n |
18.浓度均为0.1mol/L的①NaHCO3、②Na2CO3、③NaCl、④NH4Cl四种溶液,按pH值由小到大排列的顺序是( )
| A. | ①②③④ | B. | ④③①② | C. | ④③②① | D. | ②①④③ |
19.下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 | 可以加快制取氢气的速度 | Ⅰ对、Ⅱ对、无 |
| B | 用Mg-Al-NaOH构成原电池 | Mg更活泼作负极 | Ⅰ对、Ⅱ对、无 |
| C | 石墨常用做电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对、Ⅱ对、有 |
| D | MgCl2是离子化合物 | 电解MgCl2的饱和溶液制取金属镁 | Ⅰ对、Ⅱ对、有 |
| A. | A | B. | B | C. | C | D. | D |