题目内容
5.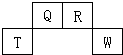 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:(1)T元素的原子结构示意图为
 .Q元素在元素周期表中的位置为第二周期ⅣA族.
.Q元素在元素周期表中的位置为第二周期ⅣA族.(2)原子序数比T少2的元素是Na(填元素符号),写出它在氧气中燃烧的化学方程式2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2.
(3)原子序数比W多4的元素是Ca(填元素符号),该元素最高价氧化物的水化物溶液与W元素最高价氧化物的水化物溶液反应的离子方程式为:Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O.
分析 根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素.
(1)T为Al元素,原子核外有13个电子,各层电子数为2、8、3;主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)原子序数比Al少2的元素是Na,在氧气中燃烧生成过氧化钠;
(3)原子序数比S多4的元素是Ca,该元素最高价氧化物的水化物是氢氧化钙,S元素最高价氧化物的水化物是硫酸,二者之间发生中和反应生成硫酸钙和水,注意硫酸钙微溶,写成化学式形成.
解答 解:根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素.
(1)T为Al元素,原子核外有13个电子,原子结构示意图为 ,Q为碳元素,原子核外有2个电子层,最外层电子数为4,在周期表中的位置是第二周期ⅣA族,
,Q为碳元素,原子核外有2个电子层,最外层电子数为4,在周期表中的位置是第二周期ⅣA族,
故答案为: ;第二周期ⅣA族;
;第二周期ⅣA族;
(2)原子序数比Al少2的元素是Na,在氧气中燃烧生成过氧化钠,反应方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
故答案为:Na;2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
(3)原子序数比S多4的元素是Ca,该元素最高价氧化物的水化物是氢氧化钙,S元素最高价氧化物的水化物是硫酸,氢氧化钙是强碱,硫酸是强酸,二者之间发生中和反应生成硫酸钙和水,离子方程式为:Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O,
故答案为:Ca;Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O.
点评 本题考查原子结构与元素周期表知识,明确元素种类是解题关键,侧重对化学用语的考查,难度不大.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 431kJ | B. | 946 kJ | C. | 649kJ | D. | 869 kJ |
| A. | CH3COCH2Cl | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
| A. | (CH3)2CHCH2Br在碱性溶液中水解 | B. | 苯在常温下与Fe、液溴反应 | ||
| C. | 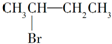 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 | D. | 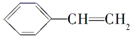 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
| A. | 乙烯 丙烯 | B. | 异戊二烯 3-甲基-1-丁炔 | ||
| C. | 甲烷 乙烯 | D. | 苯 苯乙烯 |
| A. | 完全相同 | B. | 含量无差别 | C. | 大体相同 | D. | 毫无联系 |
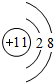 ,C的原子结构示意图是
,C的原子结构示意图是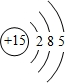 .
.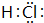 、A的氢氧化物的电子式
、A的氢氧化物的电子式 .
.
 .Q的离子符号为OH-.
.Q的离子符号为OH-.