题目内容
15.已知形成1molH-H键需放出436kJ的能量;断开1molN-H键需吸收391kJ的能量.1molN2和3molH2完全反应生成2molNH3时放出92.4kJ的能量.则要断开1molN≡N键,所需要( )| A. | 431kJ | B. | 946 kJ | C. | 649kJ | D. | 869 kJ |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,再根据放热反应进行计算,得出正确结论.
解答 解:在反应N2(g)+3H2(g)?2NH3(g)中,设要断开1molN≡N键,所需要的能量是x,则断裂3molH-H键和1molN≡N键共吸收的能量为:3×436kJ+x,生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,该反应为放热反应,放出的热量为:2346kJ-(3×436kJ+x)=92kJ,解得x=946kJ,
故选B.
点评 本题考查反应热的计算,难度不大.注意把握从键能的角度计算反应热的方法.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
5.下列说法中,不符合ⅦA元素性质特征的是( )
| A. | ⅦA族元素形成的单质的熔点随元素原子序数增大而升高 | |
| B. | ⅦA族元素易形成-1价离子 | |
| C. | 最高价氧化物的水化物显酸性 | |
| D. | 从上到下气态氢化物的稳定性依次增强 |
6.下列有机物常温下呈液态的是( )
| A. | CH3(CH2)2CH3 | B. | CH3(CH2)15CH3 | C. | CHCl3 | D. | CH4 |
10.描述CH3-CH=CH-C≡C-CH3分子结构的下列叙述中,正确的是( )
| A. | 6个碳原子有可能都在一条直线上 | B. | 6个碳原子不可能都在一条直线上 | ||
| C. | 6个碳原子有可能都在同一平面上 | D. | 6个碳原子不可能都在同一平面上 |
20.对苯乙烯( C6H5CH=CH2 )的下列说法属正确的是( )
| A. | 是乙烯的同系物 | B. | 是苯的同系物 | C. | 属于脂肪烃 | D. | 属于芳香烃 |
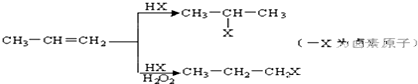
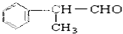 的物质,它是一种香料.
的物质,它是一种香料.
 .
. .
.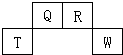 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题: .Q元素在元素周期表中的位置为第二周期ⅣA族.
.Q元素在元素周期表中的位置为第二周期ⅣA族.