题目内容
下列有关物质性质的比较顺序中,不正确的是 ( )
| A.微粒半径:K+>Na+>Mg2+>Al3+ |
| B.热稳定性:HF<HCl<HBr<HI |
| C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D.熔点:Li>Na>K>Rb |
B
解析试题分析:A.K+核外电子排布是2、8、8的电子层结构,而Na+、Mg2+、Al3+核外电子排布是2、8的电子层结构。离子核外的电子层数越多,离子半径越大。对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。因此微粒半径:K+>Na+>Mg2+>Al3+。正确。B.元素的非金属性F>Cl>Br>I.元素的非金属性越强,其氢化物就越稳定。所以热稳定性:HF>HCl>HBr>HI。错误。C.元素的非金属性Cl>S>P>Si.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。因此酸性:HClO4>H2SO4>H3PO4>H2SiO3。正确。D.:元素的金属性:Li<Na<K<Rb.元素的金属性越强,微粒间的作用力就越弱,该金属的熔点、沸点就越低。因此熔点Li>Na>K>Rb。正确。
考点:考查离子半径的比较、元素的金属性、非金属性的强弱比较及应用的知识。

 阅读快车系列答案
阅读快车系列答案X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是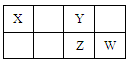
| A.Y与Z形成的化合物是形成酸雨的原因之一 |
| B.W的单质能与水反应,生成一种具有漂白性的物质 |
| C.最高价氧化物对应水化物的酸性:W >Z >X |
| D.气态氢化物的稳定性:W > Z >Y |
下列化学用语中,表示正确的是
A.2s的电子云模型是: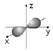 |
B.肽键的结构式为: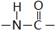 |
C.H2S分子的球棍模型为: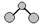 |
D.最外层电子排布式为ns2np3对应的轨道表示式为: |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
| | | X | Y |
| Z | W | | |
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍。下列判断正确的是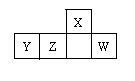
| A.原子半径:X>Y>Z>W |
| B.含Y元素的盐溶液有的显酸性,有的显碱性 |
| C.最简单气态氢化物的热稳定性:Z >W |
| D.X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
以下表示氦原子结构的化学用语中,对电子运动状态描述最详细的是( )
| A.He : | B.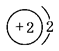 | C.1s2 | D.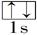 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法不正确的是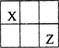
| A.原子半径:Y>Z>W |
| B.一定条件下,Y可置换出X |
| C.气态氢化物稳定性:Z>W |
| D.熔点YW2>XW4 |
依据元素周期表及元素周期律,下列推断正确的是
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
下列有关原子结构及元素周期律的叙述正确的是
| A.同主族元素的原子最外层电子数相同,化学性质也相同 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |