题目内容
【题目】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
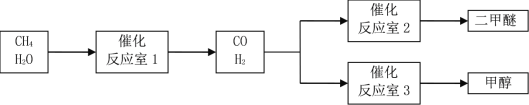
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____。
(3)反应室1中发生反应:CH4(g)+H2O (g) ![]() CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
反应时间/min | n(CH4)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______v逆(填“>”、“<”或“=”)。
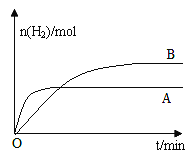
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________。
(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。
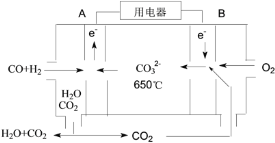
①该电池的正极反应式为_____。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________L(标准状况)。
【答案】△H<0 -211kJ/mol 0.6/t1 > 减小压强或及时分离出CO O2+2CO2+4e-=2CO32- 44.8 L
【解析】
(1)CO(g)+2H2(g)=CH3OH(g)的△S<0,由一定条件下能自发进行可知△G=△H-T△S<0,则△H<0,故答案为:△H<0。
(2)根据盖斯定律,通过①+③×2-②可得反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的△H=(-566kJ·mol-1)+2×(-484kJ·mol-1)-(-1323kJ·mol-1)=-211kJ/mol,故答案为:-211kJ/mol。
(3)①由于在t1分钟内v(CH4)=Δc/Δt=![]() =0.2/t1 mol·L-1·min-1,根据各物质的反应速率之比等于化学方程式中各物质的化学计量数之比可知:v(H2)=3v(CH4)=0.6/t1mol·L-1·min-1,故答案为:0.6/t1。
=0.2/t1 mol·L-1·min-1,根据各物质的反应速率之比等于化学方程式中各物质的化学计量数之比可知:v(H2)=3v(CH4)=0.6/t1mol·L-1·min-1,故答案为:0.6/t1。
②CH4和H2O按物质的量比1:1反应,充入1.2molCH4和0.6molH2O与充入0.6molCH4和1.2molH2O,平衡时生成物的浓度对应相同,t1分钟时,n(CH4)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2分钟时,n(H2O)=0.2mol,说明t1分钟时反应已经达到平衡状态。
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol/L) 0.6 0.3 0 0
转化(mol/L) 0.2 0.2 0.2 0.6
平衡(mol/L) 0.4 0.1 0.2 0.6
平衡常数K=![]() =
=![]() =1.08
=1.08
充入0.6molCH4和1.2molH2O,反应一段时间后,测得容器中H2的物质的量为0.60mol,
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol/L) 0.3 0.6 0 0
转化(mol/L) 0.1 0.1 0.1 0.3
一段时间后(mol/L) 0.2 0.5 0.1 0.3
Qc=![]() =
=![]() =0.027,由于K>Qc,此时向正反应方向进行,v正>v逆,故答案为:>。
=0.027,由于K>Qc,此时向正反应方向进行,v正>v逆,故答案为:>。
③根据图像可知,改变某一条件,H2的物质的量增大,达到平衡所需的时间变长,故平衡向正反应方向进行,所以可以采取减小压强或及时分离出CO的措施,故答案为:减小压强或及时分离出CO。
(4)①碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,氧气在该电极上发生还原反应,电极方程式为:2CO2+O2+4e-=2CO32-,故答案为:2CO2+O2+4e-=2CO32-。
②根据图示,碳酸盐燃料电池总的电极方程式为:H2+CO+O2=CO2+H2O,若电路中流过4mol电子,则理论上消耗CO和H2的物质的量为2mol,标准状况下总体积为2mol×22.4L/mol=44.8L,故答案为:44.8L。