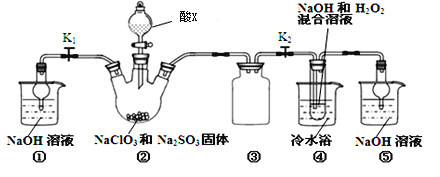
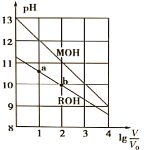
题目内容
【题目】某盐酸试剂瓶上的标签如图所示。下列有关说法正确的是(设NA表示阿伏加德罗常数的值( )
盐酸
分析纯(AR)
体积:500ml
化学式:HCl
相对分子质量:36.5
质量分数:36.5%
密度:1.19g.ml-1
A.该浓度的盐酸可用广口瓶盛装
B.该盐酸的物质的量浓度为1.19g.ml-1
C.用该盐酸配制250ml2.0mol/L的稀盐酸时需选用100ml的量筒
D.该盐酸中所含Cl-的数目为5.95NA
【答案】D
【解析】
A. 该浓度的盐酸可用细口瓶盛装,选项A错误;
B. 该盐酸的物质的量浓度为![]() =11.9mol/L,选项B错误;
=11.9mol/L,选项B错误;
C. 用该盐酸配制250ml2.0mol/L的稀盐酸时需该浓盐酸的体积为![]() 42.0mL,需选用50mL的量筒,选项C错误;
42.0mL,需选用50mL的量筒,选项C错误;
D. 该盐酸中所含Cl-的数目为![]() ×NA=5.95NA,选项D正确。
×NA=5.95NA,选项D正确。
答案选D。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
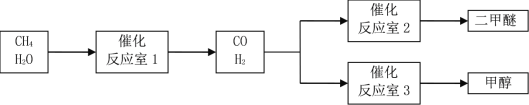
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____。
(3)反应室1中发生反应:CH4(g)+H2O (g) ![]() CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
反应时间/min | n(CH4)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______v逆(填“>”、“<”或“=”)。
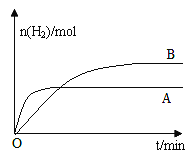
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________。
(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。
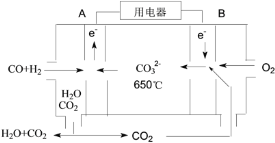
①该电池的正极反应式为_____。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________L(标准状况)。