题目内容
室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是 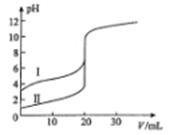
| A.II表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL |
| C.V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-) |
| D.V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-) |
B
解析试题分析:A.相同浓度的盐酸和醋酸,由于盐酸是强酸,醋酸是弱酸,所以pH醋酸的大,盐酸小。即I是醋酸,Ⅱ是盐酸。B.因为盐酸与醋酸的浓度、体积相同,即物质的量相同。若都恰好中和,得到的NaCl是强酸强碱盐,溶液为中性,而醋酸钠是强碱弱酸盐,水解显碱性,若要使pH=7时,则滴加的体积就要比盐酸少。因此滴定醋酸消耗的V(NaOH)小于20 mL。正确。C.V(NaOH)=" 20.00" mL时,根据物料守恒,可得c(Cl-)= C(CH3COO-)+ C(CH3COOH)。错误。D. V(NaOH) ="10.00" mL时,得到是醋酸和醋酸钠灯浓度的混合溶液。由于酸的电离大于盐的水解,所以溶液中C(CH3COO-)>c(Na+)> c(H+)> c(OH-)。错误。
考点:考查图像法在酸碱中和滴定及溶液中微粒浓度的大小比较中的应用的知识。

练习册系列答案
相关题目
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
| A.HCN易溶于水 |
| B.HCN溶液能导电 |
| C.1mol/L氢氰酸溶液的pH约为3 |
| D.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应 |
下列有关说法正确的是
| A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1 |
| B.铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0 |
| D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合: c(Na+)+ c(H+)= c(OH-)+c( HC2O4-) |
| D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中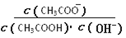 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH<7 |
室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是
| A.溶液的体积:10V甲≤V乙 |
| B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D.若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:
| A.pH=11的氨水中:c(OH-)=3.0mol·L-1 |
| B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-) |
| C.pH=2的稀盐酸中,c(H+)=c(Cl-) |
| D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) |
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是 
| A.两条曲线间任意点均有c(H+)·c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |