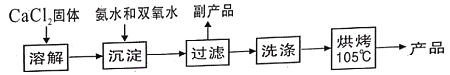
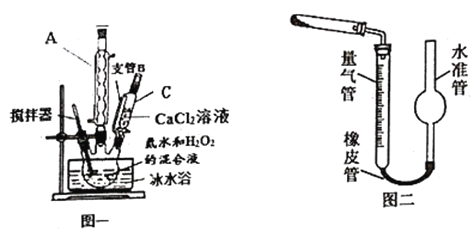
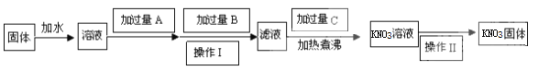
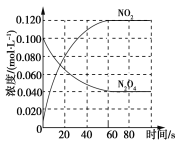
题目内容
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol·L-1,放出热量b kJ,B中C的浓度分别为
mol·L-1,放出热量b kJ,B中C的浓度分别为![]() mol·L-1,放出热量c kJ。请回答下列问题:
mol·L-1,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小:ω1_____ω2(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,在500℃时达到平衡后C的浓度为ω3 mol·L-1,则ω1、ω3的关系为_____。
(5)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
【答案】减小 ![]() a>c>b 减小 ω3>2ω1 c
a>c>b 减小 ω3>2ω1 c
【解析】
(1)因为反应为放热反应,所以升高至7000C,平衡常数减小,故答案为:减小;
(2)A为恒容容器,B是恒压容器,反应发生以后,气体的物质的量之和减小,所以B相当于在A的基础上加压,所以平衡B对于A而言是加压了,平衡向右移动,C的浓度增大,放出的热量增加,所以c>b,故答案为:w1<w2,a>c>b;
(3)打开K后,因为B端压强的大于A端的压强,所以B中压强会减小,活塞P会向左移动,故b的体积减小,故答案为:减小;
(4)B中改充入4molA2和2molB2,是A加入气体的物质的量是原来的2倍,但是压强增大会引起平衡的右移,所以w3>2w1,故答案为:w3>2w1;
(5)a、及时分离出C气体,化学反应速率减小,故a错误;b、适当升高温度,化学反应速率增大,但平衡逆向移动,故b错误;c、增大B2的浓度,化学反应速率增大,平衡正向移动,故c正确;d、选择高效的催化剂,化学反应速率增大,平衡不移动,故d错误,故选c,故答案为:c。

【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
【题目】中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定,则在操作过程中正确的顺序是__________________。(写序号)
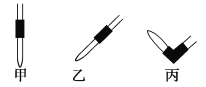
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(3)选用的指示剂是_____________________ 。(a、石蕊 b、酚酞)
(4)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(5)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(6)请根据下表中数据计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= ________________。(精确到小数点后四位)
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | 0.00 | 26.10 | 26.10 |
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(7)滴定终点的判定依据是_____________________________________________。