题目内容
【题目】某原电池装置如图所示,电池总反应为:2Ag+Cl2===2AgCl。下列说法正确的是( )
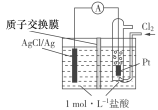
A.正极反应为AgCl+e-===Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
【答案】D
【解析】
试题分析:A、通入氯气的一极为正极,是Cl2+2e-=2Cl-,故错误;B、质子交换膜只允许H+通过,右侧没有白色沉淀生成,故错误;C、电池总反应不变,故错误;D、当有0.01mole-转移产生0.01molAg+,消耗0.01molCl-,右侧有0.01molCl-,平衡电中性,左侧0.01molH+通过质子交换膜进入右侧,因此消耗0.02mol离子,故正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目