题目内容
14.T℃时,纯水中c(OH-)为10-6mol•L-1,则该温度时,(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为9.
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是a+b=11.
分析 (1)T℃时,纯水中c(OH-)为10-6mol•L-1,则c(H+)=c(OH-)=10-6mol•L-1,离子积常数Kw=10-12,
pH=3的硫酸溶液中c(H+)=10-3 mol/L,pH=10的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-10}}$mol/L=0.01mol/L,混合溶液中c(OH-)=$\frac{0.01mol/L×2-0.001mol/L×9}{2+9}$=0.001mol/L,c(H+)=$\frac{1{0}^{-12}}{0.001}$mol/L=10-9mol/L,pH=-lg
c(H+);
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中n(H+)等于碱中n(OH-).
解答 解:(1)T℃时,纯水中c(OH-)为10-6mol•L-1,则c(H+)=c(OH-)=10-6mol•L-1,离子积常数Kw=10-12,
pH=3的硫酸溶液中c(H+)=10-3 mol/L,pH=10的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-10}}$mol/L=0.01mol/L,混合溶液中c(OH-)=$\frac{0.01mol/L×2-0.001mol/L×9}{2+9}$=0.001mol/L,c(H+)=$\frac{1{0}^{-12}}{0.001}$mol/L=10-9mol/L,pH=-lg
c(H+)=-lg10-9=9;
故答案为:9;
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中n(H+)等于碱中n(OH-),即存在10-a×1=10×10b-12,则a+b=11,
故答案为:11.
点评 本题考查酸碱混合溶液定性判断,为高频考点,正确计算该温度下离子积常数是解本题关键,注意计算碱溶液浓度方法,为易错点.

| A. | 容量瓶内含少量水 | B. | 氢氧化钠中含有少量碳酸钠 | ||
| C. | 俯视定容 | D. | 溶解后立即定容 |
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中滴加NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
 已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.
已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气. 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.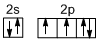 ;
;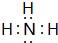 ,B的结构式为
,B的结构式为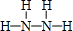 .
.