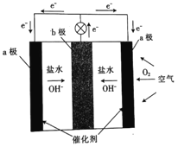
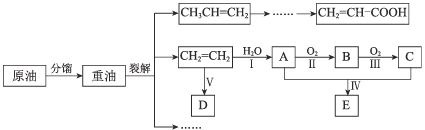
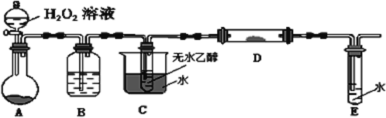
题目内容
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
【答案】B
【解析】
A.由表中数据可知,3s内氧气物质的量变化量为0.36mol,容器体积为2L,故0~3 s内v(O2)=![]() =
=![]() =0.06 mol·L-1·s-1, 根据速率之比等于其化学计量数之比,故v(NO2)=2v(O2)=2×0.06mol/(L.s)=0.12mol/(L.s),故A错误;
=0.06 mol·L-1·s-1, 根据速率之比等于其化学计量数之比,故v(NO2)=2v(O2)=2×0.06mol/(L.s)=0.12mol/(L.s),故A错误;
B.容器体积不变,在T温度下,起始时向容器中充入1.0molNO20.5molO3和0.50molN2O50.50molO2,转化到左边相当于起始投入2.0molNO2和1.0molO3,与原平衡为完全等效平衡。原平衡12s到达平衡时,氧气的物质的量为0.8mol,则:
2NO2(g)+O3(g)N2O5(g)+O2(g) 物质的量减少
1 1
0.8mol 0.8mol
由化学方程式可知,氧气的物质的量等于反应体系的总变化量,故原平衡中平衡时气体物质的量为2mol+1mol﹣0.8mol=2.2mol。由此可知,起始时向容器中充入1.0molNO20.5molO3和0.50molN2O50.50molO2到达平衡时,混合气体总物质的量为2.2mol,平衡时压强为起始的![]() =0.88倍,故B 正确;
=0.88倍,故B 正确;
C. 由表中数据可知,12s与24s时氧气的物质的量均为0.8mol,说明12s时可逆反应到达平衡,平衡时氧气的浓度为![]() =0.4mol/L,降低温度,达到新平衡时测得c(O2)=0.44mol/L,氧气浓度增大,说明降低温度,平衡向正反应方向移动,则正反应为放热反应,即△H<0,故C错误;
=0.4mol/L,降低温度,达到新平衡时测得c(O2)=0.44mol/L,氧气浓度增大,说明降低温度,平衡向正反应方向移动,则正反应为放热反应,即△H<0,故C错误;
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,转化到左边相当于起始投入4.0 mol NO2和2.0 mol O3,所到达的平衡状态相当于在原平衡的基础上压强增大一倍,平衡向正反应方向移动,平衡时N2O5的物质的量大于2×0.8 mol=1.6 mol,故参加反应的N2O5的物质的量小于2 mol-1.6 mol=0.4 mol,则达到平衡时,N2O5的转化率小于![]() ×100%=20%,故D错误。
×100%=20%,故D错误。
正确答案:B