题目内容
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)如图装置A烧瓶内试剂可选用______(填序号);①浓硫酸 ②碱石灰 ③五氧化二磷 ④烧碱固体;实验室制取氨气常用另外一种固体和固体加热的方法,写出该方法的化学方程式______________________。
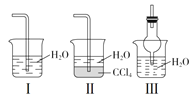
(2)若探究氨气的溶解性,上图需在K2的导管末端连接下图装置中的_________装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________________。
(3)若探究氨气的还原性,需打开K1、K3,K2处导管连接制取纯净、干燥氯气的装置,D中氨气与氯气反应产生白烟,该反应的化学方程式为__________________。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为__________,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为_____g(小数点后保留两位有效数字)。
【答案】②④ 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O II或III 用热毛巾将烧瓶捂热 8NH3+3Cl2=6NH4Cl+ N2 2NH3+3O2
CaCl2+2NH3↑+H2O II或III 用热毛巾将烧瓶捂热 8NH3+3Cl2=6NH4Cl+ N2 2NH3+3O2![]() 2HNO2+2H2O 2.35
2HNO2+2H2O 2.35
【解析】
(1)氨水易挥发,升高温度能促进氨水分解生成氨气,为促进氨水分解,则烧瓶中加入的物质遇氨水后能放出大量热,且和氨水不反应;实验室可用氢氧化钙与氯化铵加热制备氨气;
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置;利用压强差将烧杯中的水排到烧瓶中;
(3)依据氧化还原反应的规律根据反应物和生成物再结合原子守恒定律写出反应方程式;
(4)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水;结合元素的化合价变化进行计算。
氨气为碱性气体,结合上述分析可知,
①浓硫酸和氨水反应,①项错误;
②碱石灰遇水放出大量热,能使氨水温度升高,且和氨水不反应,②项符合题意;
③五氧化二磷和氨水反应,③项错误;
④烧碱固体溶解过程中放出大量热,能使氨水温度升高,且和氨水不反应,④项符合题意,
综上所述,②④正确;
实验室还可用固体氯化铵与氢氧化钙在加热条件下制备氨气,其化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O,
CaCl2+2NH3↑+H2O,
故答案为:②④;2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O;
CaCl2+2NH3↑+H2O;
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置,Ⅱ、Ⅲ装置中都有缓冲装置,Ⅰ没有缓冲装置能产生倒吸,故选Ⅱ或Ⅲ;利用压强差将烧杯中的水排到烧瓶中,操作为用热毛巾将烧瓶捂热,烧瓶中的空气进入烧杯中,导致大气压强大于烧瓶中气体压强,从而使烧杯中的水通过导管进入烧瓶中产生喷泉实验,
故答案为:Ⅱ或Ⅲ;用热毛巾将烧瓶捂热;
(3)氨气与氯气反应产生白烟的同时还生成氮气,结合氧化还原反应的规律可知所以其反应方程式为:8NH3+3Cl2=6NH4Cl+ N2,
故答案为:8NH3+3Cl2=6NH4Cl+ N2;
(4)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水,该反应为2NH3+3O2![]() 2HNO2+2H2O,由反应可知,N的化合价由-3价升高为+3价,故生成1molHNO2时转移1mol×[3-(-3)]=6mol电子,则有0.3mol电子发生转移时,生成亚硝酸
2HNO2+2H2O,由反应可知,N的化合价由-3价升高为+3价,故生成1molHNO2时转移1mol×[3-(-3)]=6mol电子,则有0.3mol电子发生转移时,生成亚硝酸![]() =0.05mol,其质量为0.05mol×47g/mol=2.35g,
=0.05mol,其质量为0.05mol×47g/mol=2.35g,
故答案为:2NH3+3O2![]() 2HNO2+2H2O;2.35。
2HNO2+2H2O;2.35。

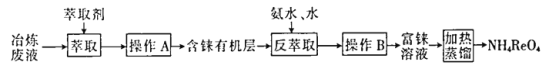
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
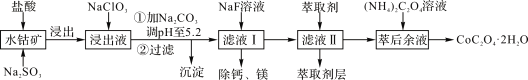
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:_________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2
H++HC2O4- Ka1=5.4×10-2
HC2O4-![]() H+C2O42- Ka2=5.4×10-5
H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH______7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是________。